一 : 原电池与电解池在生活和生产中有着广泛应用。下列有关判断中错误的是装置①装置②装置③A.装置①研究的是
原电池与电解池在生活和生产中有着广泛应用。下列有关判断中错误的是 装置①装置②装置③
|
| C |
试题分析:A、装置①中b极是阴极,阳离子放电,所以有红铜析出,正确;B、装置②中Fe、C、食盐水构成原电池,在中性环境中铁易发生吸氧腐蚀,铁做负极,发生的反应为Fe-2e-= Fe2+,正确;C、装置③中B极为阴极,阳离子放电,则B极有氢气放出,氯气应在A极放出,错误;D、电化学反应均是氧化还原反应,正确,答案选C。 |
考点:
考点名称:原电池原理的应用原电池原理的应用:原电池原理的应用:
1.比较不同金属的活动性强弱
根据原电池原理可知,在原电池反应过程中,一般活动性强的金属作负极,而活动性弱的金属(或能导电的非金属)作正极。
若有两种金属A和B,用导线将A和B连接后,插入到稀硫酸中,一段时间后,若观察到A极溶解,而B 极上有气体放出,说明在原电池工作过程中,A被氧化成阳离子而失去电子作负极,B作正极,则金属A的金属活动性比B强。
2.加快氧化还原反应的速率
因为形成原电池后,产生电位差,使电子的运动速率加快,从而使反应速率增大,如Zn与稀H2SO4反应制氧气时,可向溶液中滴加少量CuSO4溶液,形成Cu—Zn原电池,加快反应速率 3.用于金属的防护要保护一个铁制闸门,可用导线将其与一锌块相连,使锌作原电池的负极,铁制闸门作正极。
4.设计制作化学电源设计原电池时要紧扣构成原电池的条件。
(1)首先要将已知氧化还原反应拆分为两个半反应:
(2)然后根据原电池的电极反应特点,结合两个半反应找出正、负极材料(一般负极就是失电子的物质,正极用比负极活泼性差的金属或导电的非金属)及电解质溶液:
①电解质溶液的选择电解质溶液一般要能够与负极发生反应,或者能与电极产物发生反应。但如果两个半反应分别在两个容器中进行(中间连接盐桥),左右两个容器中的电解质溶液应选择与电极材料相同的阳离子。如在铜一锌一硫酸铜构成的原电池中,负极金属锌浸泡在含有 Zn2+“的电解质溶液中,而正极铜浸泡在含有Cu2+的溶液中.
②电极材料的选择在原电池中,选择较活泼的金属或还原性较强的物质作为负极,较不活泼的金属或能导电的非金属或氧化性较强的物质作为正极。一般,原电池的负极能够与电解质溶液反应,容易失去电子,因此负极一般是活泼的金属材料(也可以是还原性较强的非金属材料如H2、CH4等)。
(3)举例根据以下反应设计原电池: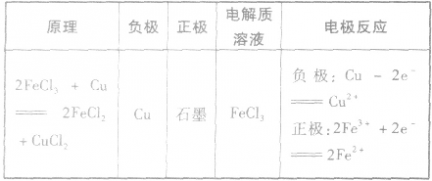
原电池的构成条件:
(1)活泼性不同的两个电极。
(2)电解质溶液,一般能与较活泼金属自发地进行氧化还原反应。
(3)形成闭合回路。
原电池中盐桥的作用:
盐桥中的盐溶液是电解质溶液(通常装有含琼胶的KCl饱和溶液),能使两烧杯中的溶液连成一个通路。通过盐桥中阴、阳离子的定向移动(阳离子移向正极,阴离子移向负极)维持两个半电池的电中性,以使原电池连续工作。盐桥将氧化还原反应的两个半反应隔开进行,能提高原电池的工作效率,减缓电流衰减。

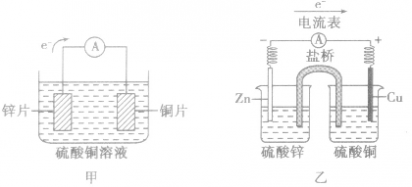
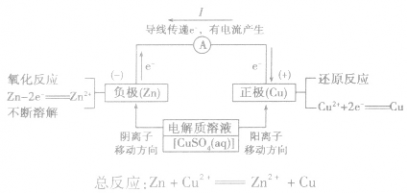
原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
二 : 电磁泵在目前的生产、科技中得到了广泛应用。如图所示,
电磁泵在目前的生产、科技中得到了广泛应用。如图所示,泵体是一个长方体,ab边长为L1,两侧端面是边长为L2的正方形;流经泵体内的液体密度为ρ、在泵头通入导电剂后液体的电导率为σ(电阻率的倒数),泵体所在处有方向垂直向外的磁场B,把泵体的上下两表面接在电压为U(内阻不计)的电源上,则()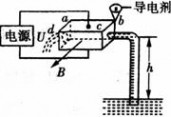
|
| AC |
试题分析:当泵体上表面应接电源正极时,电流从上向下流过泵体,这时受到的磁场力水平向右,拉动液体,因此A正确;泵体电阻 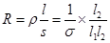 ,因此流过泵体的电流 ,因此流过泵体的电流  ,B错误;增大磁感应强度B,受到的磁场力变大,因此可获得更大的抽液高度,C正确,但若增大液体的电阻率。可使I减小,受到的磁场力减小,使抽液高度减小,D错误 ,B错误;增大磁感应强度B,受到的磁场力变大,因此可获得更大的抽液高度,C正确,但若增大液体的电阻率。可使I减小,受到的磁场力减小,使抽液高度减小,D错误 |
考点:
考点名称:电阻定律、电阻率电阻:
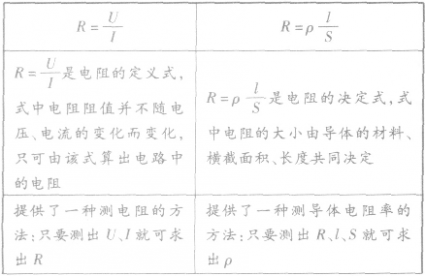
1、定义:导体两端的电压和通过它的电流的比值叫做电阻,符号为R
2、定义式: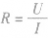 ,
,
3、单位:简称欧,符号Ω。1Ω=1V/A
4、意义:描述导体对电流阻碍作用大小的物理量.电阻越大,同样电压下形成的电流越小
电阻定律:
1、电阻的定义:导体两端的电压与通过导体中的电流的比值叫导体的电阻。
①定义式:R=U/I,单位:Ω。
②电阻是导体本身的属性,跟导体两端的电压及通过电流无关。
2、电阻定律的内容:在温度不变时,导体的电阻R与它的长度L成正比,与它的横截面积S成反比。即R=ρL/S。
电阻率:
1、定义:ρ是反映材料导电性能的物理量,称为电阻率,和物体的材料、温度有关。
2、计算公式: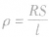
3、决定因素:
4、与温度的关系:由材料的种类和温度决定,与材料的长短、粗细无关。一般常用合金的电阻率大于组成它的纯金属的电阻率各种材料的电阻率都随温度的变化而变化:
①金属的电阻率随温度的升高而增大(可用于制造电阻温度计);
②半导体和电介质的电阻率随温度的升高而减小(半导体的电阻率随温度的变化较大,可用于制造热敏电阻);
③有些合金如锰铜、镍铜的电阻率几乎不随温度的变化而变化(可用来制作标准电阻);
④当温度降低到绝对零度附近时,某些材料的电阻率突然减小为零,成为超导体
5、单位:欧·米,符号Ω·m
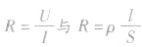 的比较:
的比较:

导体折叠、截取或拉伸后电阻的计算方法:
某导体形状改变后,因总体积不变,电阻率不变,当长度 和面积
和面积 变化时,应用
变化时,应用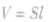 来确定S和l在形变前后的关系,分别应用电阻定律即可求出l和S变化前后的电阻关系。在导体被折叠成n段时,导体的长度变成原来的
来确定S和l在形变前后的关系,分别应用电阻定律即可求出l和S变化前后的电阻关系。在导体被折叠成n段时,导体的长度变成原来的 ,横截面积变成原来的n倍。截取时横截面积不变。几拉伸时若长度变为原来的n倍,则横截面积变为原来的
,横截面积变成原来的n倍。截取时横截面积不变。几拉伸时若长度变为原来的n倍,则横截面积变为原来的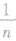 ;若横截面半径变为原来的
;若横截面半径变为原来的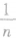 时,截面面积变为原来的
时,截面面积变为原来的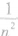 ,长度是原来的n2倍:
,长度是原来的n2倍:
三 : (2分)光电鼠标在电脑中应用非常广泛,其原理就是利用光
(2分)光电鼠标在电脑中应用非常广泛,其原理就是利用光源照射鼠标垫表面(如图所示),并被反射回光学感应器(相当于光屏),当鼠标移动时,感应器会连续接收鼠标垫表面所成的像,并利用数字信号来处理比较各个影像,以确定移动的距离和方向.产生的结果传回计算机,而屏幕上的光标会根据这些结果来移动.图中光学感应器、透镜、光源等元件固定在鼠标内,当光源的光照射在粗糙的鼠标垫上时会发生 反射;当鼠标平放在鼠标垫上,凸透镜到鼠标垫的距离为7mm,光学感应器距凸透镜3mm,则在光学感应器上成 像.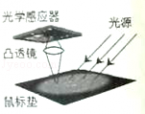 |
| 漫;实. |
试题分析:当发光二极管的光照射在粗糙的鼠标垫上时,发生漫反射; 感应器连续拍摄鼠标垫表面所成的像是利用二倍焦距以外的物体成像的原理,因此光学感应器上所成的是倒立、缩小的实像. |
考点:
考点名称:光的反射现象光的反射现象:四 : 原电池与电解池在生活和生产中有着广泛应用。下列有关
原电池与电解池在生活和生产中有着广泛应用。下列有关判断中错误的是 装置①装置②装置③
|
| C |
试题分析:A、装置①中b极是阴极,阳离子放电,所以有红铜析出,正确;B、装置②中Fe、C、食盐水构成原电池,在中性环境中铁易发生吸氧腐蚀,铁做负极,发生的反应为Fe-2e-= Fe2+,正确;C、装置③中B极为阴极,阳离子放电,则B极有氢气放出,氯气应在A极放出,错误;D、电化学反应均是氧化还原反应,正确,答案选C。 |
考点:
考点名称:原电池原理的应用原电池原理的应用:原电池原理的应用:
1.比较不同金属的活动性强弱
根据原电池原理可知,在原电池反应过程中,一般活动性强的金属作负极,而活动性弱的金属(或能导电的非金属)作正极。
若有两种金属A和B,用导线将A和B连接后,插入到稀硫酸中,一段时间后,若观察到A极溶解,而B 极上有气体放出,说明在原电池工作过程中,A被氧化成阳离子而失去电子作负极,B作正极,则金属A的金属活动性比B强。
2.加快氧化还原反应的速率
因为形成原电池后,产生电位差,使电子的运动速率加快,从而使反应速率增大,如Zn与稀H2SO4反应制氧气时,可向溶液中滴加少量CuSO4溶液,形成Cu—Zn原电池,加快反应速率 3.用于金属的防护要保护一个铁制闸门,可用导线将其与一锌块相连,使锌作原电池的负极,铁制闸门作正极。
4.设计制作化学电源设计原电池时要紧扣构成原电池的条件。
(1)首先要将已知氧化还原反应拆分为两个半反应:
(2)然后根据原电池的电极反应特点,结合两个半反应找出正、负极材料(一般负极就是失电子的物质,正极用比负极活泼性差的金属或导电的非金属)及电解质溶液:
①电解质溶液的选择电解质溶液一般要能够与负极发生反应,或者能与电极产物发生反应。但如果两个半反应分别在两个容器中进行(中间连接盐桥),左右两个容器中的电解质溶液应选择与电极材料相同的阳离子。如在铜一锌一硫酸铜构成的原电池中,负极金属锌浸泡在含有 Zn2+“的电解质溶液中,而正极铜浸泡在含有Cu2+的溶液中.
②电极材料的选择在原电池中,选择较活泼的金属或还原性较强的物质作为负极,较不活泼的金属或能导电的非金属或氧化性较强的物质作为正极。一般,原电池的负极能够与电解质溶液反应,容易失去电子,因此负极一般是活泼的金属材料(也可以是还原性较强的非金属材料如H2、CH4等)。
(3)举例根据以下反应设计原电池: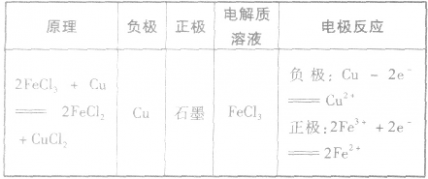
原电池的构成条件:
(1)活泼性不同的两个电极。
(2)电解质溶液,一般能与较活泼金属自发地进行氧化还原反应。
(3)形成闭合回路。
原电池中盐桥的作用:
盐桥中的盐溶液是电解质溶液(通常装有含琼胶的KCl饱和溶液),能使两烧杯中的溶液连成一个通路。通过盐桥中阴、阳离子的定向移动(阳离子移向正极,阴离子移向负极)维持两个半电池的电中性,以使原电池连续工作。盐桥将氧化还原反应的两个半反应隔开进行,能提高原电池的工作效率,减缓电流衰减。

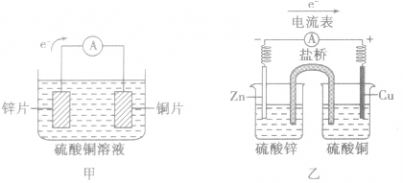

原电池中的电荷流动:
在外电路(电解质溶液以外),电子(负电荷)由负极经导线(包括电流表和其他用电器)流向正极,使负极呈正电性趋势、正极呈负电性趋势。在内电路(电解质溶液中),阳离子(带正电荷)向正极移动,阴离子 (带负电荷)向负极移动。这样形成了电荷持续定向流动,电性趋向平衡的闭合电路。
五 : 09外本11班崔晓菲01《英语习语在日常生活中的应用》19
本文标题:铝制品在日常生活中应用广泛-原电池与电解池在生活和生产中有着广泛应用。下列有关判断中错误的是装置①装置②装置③A.装置①研究的是61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1