一 : 人体的死亡属于物质存在形式的分解和转化
一、人体的存在和命运的思考
人体属于物质的精灵的存在形式;人体有内在根据的顽强的适应自然而生长壮老已;人体内部间及人体内部与宇宙万物间,联系、协调、平衡;人体发展变化的动力,来源于人体内部间及人体内部与宇宙万物间的种种对立、斗争;人体求存在、求利益、求发展、求自由;人体在适应和拼搏中,表现自己的质量、性质、能力,完成自己肩负的历史使命。
二、人体的死亡属于物质存在形式的分解和转化
1、人体的死亡
无论何种原因,若破坏了人体内部间及人体内部与宇宙万物间的动态平衡(天人合一或说阴阳平衡),人体就逐渐死亡。
人体死亡的瞬间,可能分解为两部分物质:停止了内、外动态平衡的肉体,等待火化或腐烂,等待参与其他事物的组成;分解出一部分精华物质,游存于适宜的宇宙空间,或参与其他事物的组成。( 文章阅读网:www.61k.com )
2、从人体分解出精华物质的迹象
人体健康时,有本能的良好的防御机制,对人体不利的信息,不易侵入人体;人体病重或体弱或极度放松时,人脑易于接收、破译、表演不良信息。如:人病重,说见鬼,见已故亲人,说亲人要钱花;人病重或病危或灾祸,不知情的亲人,会做离奇古怪的梦;据“死去”(没真死)又“活过来”的人说,自己先坠入深渊,又站在天花板上,见亲人在哭;据说,有人用照相机拍下了飘离死人的物质,等等。
3、从人体分离出精华物质的探索
人体死亡的瞬间,是否分离出精华物质,没有可靠的依据;我仅从理论和迹象上去探索;我希望大家发表看法;我希望大家评头品足;以期共同探索生命的奥秘!
二 : 化学推断题有ABCD四种物质。A和B可以相互转化;B在沸水中生成
化学推断题
有AB四种物质。
A和B可以相互转化;
B在沸水中生成C;
C在空气中久置可生成有臭鸡蛋气味的D。
好老哦~~
楼上的这个是以前的一个玩笑问题~
就这么简单!
鸡蛋可以和鸡互相转换~(鸡生蛋~蛋生鸡~)
蛋在水里煮孰后变成熟鸡蛋~
鸡蛋在跟空气接触氧化后变质出现臭鸡蛋味道~
三 : 感受态的制备与转化,质粒提取(原理和操作步骤)
天马波波
感受态的制备与转化,质粒提取(原理和操作步骤)
感受态细胞: 理化方法诱导细胞,使其处于最适摄取和容纳外来DNA的生理状态。即指细菌细胞在一定的生长阶段,自身或通过人为处理而具有摄取外源DNA并使其基因型和表现型发生相应变化的能力。如大肠杆菌经CaCl2处理,就成为容易受质粒DNA转化的细胞。
一般来说,感受态细胞的最基本要求是:
1、没有质粒
2、容易被转进去(一般是G-细菌,细胞壁薄)
3、营养条件一般,非苛养菌
CaCl2法:
操作原理:
1.将快速生长的大肠杆菌置于经低温(0℃)预处理的低渗氯化钙溶液中,便会造成细胞膨胀,同时Ca2+会使细胞膜磷脂双分子层形成液晶结构,促使细胞外膜与内膜间隙中的部分核酸酶解离开来,离开所在区域,诱导细胞成为感受态细胞
细胞膜通透性发生变化,极易与外源DNA相粘附并在细胞表面形成抗脱氧核糖核
酸酶的羟基-磷酸钙复合物。
2.此时,将该体系转移到42℃下做短暂的热刺激(90s),细胞膜的液晶结构会发生剧烈扰动,并随机出现许多间隙,外源DNA就可能被细胞吸收。进入细胞的外源DNA分子通过复制、表达,实现遗传信息的转移,使受体细胞出现新的遗传性状。
3.将转化后的细胞在上培养,筛选出带有外源DNA分子的。 意义:
将构建好的载体转入感受态细胞进行表达,不仅可以检验重组载体是否构建成功,最主要的是感受态细胞作为重组载体的宿主可以进行后续实验,如蛋白质表达纯化等工作。
细菌处于容易吸收外源DNA的状态叫感受态。
转化是指质粒DNA或以他为载体构建的重组子导入细菌的过程。
实验材料:E. coli DH5α菌株: Rˉ,Mˉ,Ampˉ;pBS质粒DNA;eppendorf管。 试剂:
1.LB固体和液体培养基
2.Amp母液 (储存浓度 50mg/ml)
3.含Amp的LB固体培养基:将配好的LB固体培养基高压灭菌后冷却至60℃左右,加入 Amp储存液,使终浓度为50ug/ml,摇匀后铺板。
4.0.05mol/L CaCl2溶液:称取0.28g CaCl2(无水,分析纯),溶于50ml重蒸水中,定容至 100ml,高压灭菌。
天马波波
5.含15%甘油的0.05mol/L CaCl2: 称取0.28g CaCl2(无水,分析纯),溶于50ml重蒸水 中,加入15ml甘油,定容至100ml,高压灭菌。

50-100mg/mL;
10mmol/L EDTA(pH8.0), 25mmol/L Tris-HCl (pH8.0);
现配现用);
的5mol/L KAc, 11.5ml 冰醋酸,28.5mL H2O);
一、 受体菌的培养
-80℃冰柜中,取出一支冻存菌株,于事先照过紫外的超净台中,用无菌的接种环轻轻蘸取菌种后,在无抗平板上划线,并将菌种迅速放回-80℃保存。在划线板上做好相应标记,于37℃培养16-20小时。
在照过紫外的超净台中,用灼烧并冷却后的镊子夹住一个20μl枪头(或者灭过菌的牙签), 从LB平板上挑取新活化的E. coli DH5α单菌落,接种于3-5ml LB液体培养基中,37℃下振荡培养12小时左右(或过夜,220rpm),直至对数生长后期。将该菌悬液以1:100-1:50的比例接种于100ml LB液体培养基中(据其他资料:取50或100ul菌液接种于5ml的培养基中),37℃振荡培养2-3小时至OD600 =0.3~0.5左右。细胞数小于10的8次方, 过夜菌按比例转接至准备好的液体培养基中。一般转接菌液与培养基体积比例不得大于1:10,即转接菌液:培养基体积≦ 1:10。 培养基体积与三角瓶体积比不得小于1:5,即培养基体积:三角瓶体积≧ 1:5。 要有足够的空间提供溶氧。)
OD值是一个重要的参数,当OD600值大于一定值时,菌体不会保持对数生长。同时, OD值大时菌体总量达,所以需要在这两个方面的影响中找到一个平衡点。不同的菌种所对应的值不一样。
二、 感受态细胞的制备 ( CaCl2 法)
1、将细菌悬液液转入离心管(1.5ml)中,冰上放置10分钟,然后于4℃下3000g离心10分钟。
2、 弃去上清,用预冷的0.05mol/L的CaCl2 溶液10ml轻轻悬浮细胞,冰上放置15-30分钟后,4℃下3000g离心10分钟。 (有些微0.1mol/L的CaCl2)
3、弃去上清,加入4ml预冷含15%甘油的0.05mol/L的CaCl2 溶液,轻轻悬浮细胞,冰上放置几分钟,即成感受态细胞悬液。(15% - 20%甘油为细菌的冷冻保护剂,也可在此步骤不加甘油,细胞直接用于转化)
4、 感受态细胞分装成200μl的小份,贮存于-70℃可保存半年。
三、 转化
1、从-70℃冰箱中取200μl感受态细胞悬液,室温下使其解冻,解冻后立即置冰上。
2、 加入pBS质粒DNA溶液(含量不超过50ng,体积不超过10μl),轻轻摇匀,冰上放置30
分钟后。 (有资料为200ul加1ng质粒)
3、42℃水浴中热击90秒或37℃水浴5分钟,热击后迅速置于冰上冷却3-5分钟。
4、向管中加入1ml LB液体培养基(不含Amp),混匀后37℃振荡培养1小时,使细菌恢复
正常生长状态,并表达质粒编码的抗生素抗性基因(Ampr )。
5、将上述菌液摇匀后取100μl 涂布于含Amp的筛选平板上,正面向上放置半小时,待菌液
完全被培养基吸收后倒置培养皿,37℃培养16-24小时。
天马波波
同时应做两个对照:
对照组1: 以同体积的无菌双蒸水代替DNA溶液,其它操作与上面相同。此组正常
情况下在含抗生素的LB平板上应没有菌落出现。
对照组2: 以同体积的无菌双蒸水代替DNA溶液,但涂板时只取5μl 菌液涂布于
不含抗生素的LB平板上,此组正常情况下应产生大量菌落。
四、 计算转化率
统计每个培养皿中的菌落数。
转化后在含抗生素的平板上长出的菌落即为转化子,根据此皿中的菌落数可计算出转化 子总数和转化频率,公式如下:
转化子总数=菌落数×稀释倍数×转化反应原液总体积/涂板菌液体积
转化频率(转化子数/每mg质粒DNA)=转化子总数/质粒DNA加入量(mg) 感受态细胞总数=对照组2菌落数×稀释倍数×菌液总体积/涂板菌液体积
感受态细胞转化效率=转化子总数/感受态细胞总数
注意事项:本实验方法也适用于其它E.coli受体菌株的不同的质粒DNA的转化。但它们的转化效率并不一定一样。有的转化效率高,需将转化液进行多梯度稀释涂板才能得到单菌落平板,而有的转化效率低,涂板时必须将菌液浓缩(如离心),才能较准确的计算转化率。

(1)转化缓冲液中试剂的纯度务必使用所能得到的最高质量的试剂,这些试剂应分装成小
份,避光保存于冷处。
(2)细胞的生长状态由于一些不清楚的原因,直接用贮存于-70℃冰冻培养基中的贮存原
种接种而进持培养的细菌,所得到的转化效率最高,不应使用在实验室中连续传代,
贮存于4℃或贮存于室温的培养物。
(3)玻璃和塑料器皿的清洁度痕量的去污剂或其他化学物质的存在可能大大地降低细菌的
生长效率,所以最好拨出一批玻璃器皿专用于制备感受态细菌,而不作它用。
制备感受态细胞时,测OD600 在0.3--0.5之间,空白用无菌体的LB培养基。(菌体的OD600值,JM109或BL21,OD值为0.35,DH5α为0.4,要尽量保证OD值不要过高,更不能超过0.6)
感受态的感受效率最关键的是一个冷字,刚制备的感受态其感受效果最好,但是随着时间的延长感受效果会逐渐下降,所以要将制好的感受态细胞冻存于液氮中,或-70度冰箱保存,这样感受效果才不至下降过快。一般感受态制备好以后24小时其转化效率最高,随后就逐渐下降。一般的宿主菌都不要传代太多,传多了就容易状态不好和污染杂菌。状态好的时候建议冻上一批,用EP管分装好,然后,每次就可以取冻存的菌种来扩增使用。
试剂和用品,非如果有可能,所有的用品(离心管、摇瓶等等)用新的,如果使用旧的,要确保干净。
制备质粒DNA:
碱裂解法小量制备质粒DNA:碱裂解法是基于线性大分子染色体DNA与小分子环形质粒DNA的变性复性的差异达到分离目的的,在pH12.0~12.6的碱性环境中,线型染色体DNA和环型质粒DNA氢键会发生断裂,双链解开而变性,但质粒DNA由于其闭合环型结构,氢
天马波波
键仅发生部分断裂,而且其互补链不完全分离;当将pH值调节到中性并在高盐浓度下,已分开的染色体DNA互补链不能复性而交联形成不溶的网状结构,通过离心,大部分染色体DNA、不稳定的大分子RNA和蛋白质-SDS复合物等一起沉淀下来而被除去,而部分变性的闭合环状的质粒DNA在中性条件下很快复性,恢复到原来的构型,呈可溶性状态保存与溶液中,离心后上清中便含有所需要的质粒DNA。

1、挑取转化筛选的带有目的质粒的大肠杆菌接种到液体培养基中,37℃震荡培养12~16小
时;
2、将1.5mL菌液加入Ep离心管中,12000 g离心30 Sec,弃上清液,在吸水纸上扣干;
离心时间不能太长,以免影响下一步的菌体悬浮
3、加入100mL预冷的溶液I ,于涡旋振荡器上振荡悬浮细菌细胞,尽量使细胞分散;
溶液I中的葡萄糖的作用是增大让一让的粘度,减少提取过程中的机械剪切力,防止染色体DNA 的断裂;EDTA的作用是与二价离子(Ca2+)结合,降低DNase对DNA的降解。
4、加入200mL新配制的溶液II, 盖紧管口,快速颠倒离心管,以混匀内容物,冰上放置3-5min;
溶液II中的NaOH与SDS可裂解细胞,使DNA变性以及SDS使蛋白变性并形成交联的网状结构
5、加入150ml溶液III, 加盖后颠倒6-7次混匀,冰上放置2~3min;
溶液III为低pH的醋酸钾缓冲液,中和NaOH,以便使部分变性的闭环质粒复性,而细菌染色体DNA不能正确复性
6、12000 g离心6 min,将上清移入另一干净的Ep管中;
7、加2倍上清体积(约1mL)的无水乙醇, 振荡混匀,室温放置2min.
8、12000g离心10min,弃上清液,再用70%的乙醇洗涤一次, 12000g离心1min,离心管倒
置于吸水纸上扣干,然后在中空浓缩系统上干燥质粒;
9、加入40mL含20 mg/mL RNase A的灭菌蒸馏水或TE 缓冲液溶解提取物,室温放置直到质
粒完全溶解(约8min),存于-20℃或直接用于酶切。
质粒图谱:
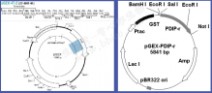
(四)提取质粒的酶切鉴定与琼脂糖凝胶电泳:
1、在0.5mL Ep管中依次加入下列溶液于0.5ml离心管中
四 : 感受态的制备与转化,质粒提取(原理和操作步骤)
天马波波
感受态的制备与转化,质粒提取(原理和操作步骤)
感受态细胞: 理化方法诱导细胞,使其处于最适摄取和容纳外来DNA的生理状态。(www.61k.com)即指细菌细胞在一定的生长阶段,自身或通过人为处理而具有摄取外源DNA并使其基因型和表现型发生相应变化的能力。如大肠杆菌经CaCl2处理,就成为容易受质粒DNA转化的细胞。
一般来说,感受态细胞的最基本要求是:
1、没有质粒
2、容易被转进去(一般是G-细菌,细胞壁薄)
3、营养条件一般,非苛养菌
CaCl2法:
操作原理:
1.将快速生长的大肠杆菌置于经低温(0℃)预处理的低渗氯化钙溶液中,便会造成细胞膨胀,同时Ca2+会使细胞膜磷脂双分子层形成液晶结构,促使细胞外膜与内膜间隙中的部分核酸酶解离开来,离开所在区域,诱导细胞成为感受态细胞
细胞膜通透性发生变化,极易与外源DNA相粘附并在细胞表面形成抗脱氧核糖核
酸酶的羟基-磷酸钙复合物。
2.此时,将该体系转移到42℃下做短暂的热刺激(90s),细胞膜的液晶结构会发生剧烈扰动,并随机出现许多间隙,外源DNA就可能被细胞吸收。进入细胞的外源DNA分子通过复制、表达,实现遗传信息的转移,使受体细胞出现新的遗传性状。
3.将转化后的细胞在上培养,筛选出带有外源DNA分子的。 意义:
将构建好的载体转入感受态细胞进行表达,不仅可以检验重组载体是否构建成功,最主要的是感受态细胞作为重组载体的宿主可以进行后续实验,如蛋白质表达纯化等工作。
细菌处于容易吸收外源DNA的状态叫感受态。
转化是指质粒DNA或以他为载体构建的重组子导入细菌的过程。
实验材料:E. coli DH5α菌株: Rˉ,Mˉ,Ampˉ;pBS质粒DNA;eppendorf管。 试剂:
1.LB固体和液体培养基
2.Amp母液 (储存浓度 50mg/ml)
3.含Amp的LB固体培养基:将配好的LB固体培养基高压灭菌后冷却至60℃左右,加入 Amp储存液,使终浓度为50ug/ml,摇匀后铺板。
4.0.05mol/L CaCl2溶液:称取0.28g CaCl2(无水,分析纯),溶于50ml重蒸水中,定容至 100ml,高压灭菌。
质粒转化 感受态的制备与转化,质粒提取(原理和操作步骤)
天马波波
5.含15%甘油的0.05mol/L CaCl2: 称取0.28g CaCl2(无水,分析纯),溶于50ml重蒸水 中,加入15ml甘油,定容至100ml,高压灭菌。(www.61k.com]

50-100mg/mL;
10mmol/L EDTA(pH8.0), 25mmol/L Tris-HCl (pH8.0);
现配现用);
的5mol/L KAc, 11.5ml 冰醋酸,28.5mL H2O);
一、 受体菌的培养
-80℃冰柜中,取出一支冻存菌株,于事先照过紫外的超净台中,用无菌的接种环轻轻蘸取菌种后,在无抗平板上划线,并将菌种迅速放回-80℃保存。在划线板上做好相应标记,于37℃培养16-20小时。
在照过紫外的超净台中,用灼烧并冷却后的镊子夹住一个20μl枪头(或者灭过菌的牙签), 从LB平板上挑取新活化的E. coli DH5α单菌落,接种于3-5ml LB液体培养基中,37℃下振荡培养12小时左右(或过夜,220rpm),直至对数生长后期。将该菌悬液以1:100-1:50的比例接种于100ml LB液体培养基中(据其他资料:取50或100ul菌液接种于5ml的培养基中),37℃振荡培养2-3小时至OD600 =0.3~0.5左右。细胞数小于10的8次方, 过夜菌按比例转接至准备好的液体培养基中。一般转接菌液与培养基体积比例不得大于1:10,即转接菌液:培养基体积≦ 1:10。 培养基体积与三角瓶体积比不得小于1:5,即培养基体积:三角瓶体积≧ 1:5。 要有足够的空间提供溶氧。)
OD值是一个重要的参数,当OD600值大于一定值时,菌体不会保持对数生长。同时, OD值大时菌体总量达,所以需要在这两个方面的影响中找到一个平衡点。不同的菌种所对应的值不一样。
二、 感受态细胞的制备 ( CaCl2 法)
1、将细菌悬液液转入离心管(1.5ml)中,冰上放置10分钟,然后于4℃下3000g离心10分钟。
2、 弃去上清,用预冷的0.05mol/L的CaCl2 溶液10ml轻轻悬浮细胞,冰上放置15-30分钟后,4℃下3000g离心10分钟。 (有些微0.1mol/L的CaCl2)
3、弃去上清,加入4ml预冷含15%甘油的0.05mol/L的CaCl2 溶液,轻轻悬浮细胞,冰上放置几分钟,即成感受态细胞悬液。(15% - 20%甘油为细菌的冷冻保护剂,也可在此步骤不加甘油,细胞直接用于转化)
4、 感受态细胞分装成200μl的小份,贮存于-70℃可保存半年。
三、 转化
1、从-70℃冰箱中取200μl感受态细胞悬液,室温下使其解冻,解冻后立即置冰上。
2、 加入pBS质粒DNA溶液(含量不超过50ng,体积不超过10μl),轻轻摇匀,冰上放置30
分钟后。 (有资料为200ul加1ng质粒)
3、42℃水浴中热击90秒或37℃水浴5分钟,热击后迅速置于冰上冷却3-5分钟。
4、向管中加入1ml LB液体培养基(不含Amp),混匀后37℃振荡培养1小时,使细菌恢复
正常生长状态,并表达质粒编码的抗生素抗性基因(Ampr )。
5、将上述菌液摇匀后取100μl 涂布于含Amp的筛选平板上,正面向上放置半小时,待菌液
完全被培养基吸收后倒置培养皿,37℃培养16-24小时。
质粒转化 感受态的制备与转化,质粒提取(原理和操作步骤)
天马波波
同时应做两个对照:
对照组1: 以同体积的无菌双蒸水代替DNA溶液,其它操作与上面相同。[www.61k.com]此组正常
情况下在含抗生素的LB平板上应没有菌落出现。
对照组2: 以同体积的无菌双蒸水代替DNA溶液,但涂板时只取5μl 菌液涂布于
不含抗生素的LB平板上,此组正常情况下应产生大量菌落。
四、 计算转化率
统计每个培养皿中的菌落数。
转化后在含抗生素的平板上长出的菌落即为转化子,根据此皿中的菌落数可计算出转化 子总数和转化频率,公式如下:
转化子总数=菌落数×稀释倍数×转化反应原液总体积/涂板菌液体积
转化频率(转化子数/每mg质粒DNA)=转化子总数/质粒DNA加入量(mg) 感受态细胞总数=对照组2菌落数×稀释倍数×菌液总体积/涂板菌液体积
感受态细胞转化效率=转化子总数/感受态细胞总数
注意事项:本实验方法也适用于其它E.coli受体菌株的不同的质粒DNA的转化。但它们的转化效率并不一定一样。有的转化效率高,需将转化液进行多梯度稀释涂板才能得到单菌落平板,而有的转化效率低,涂板时必须将菌液浓缩(如离心),才能较准确的计算转化率。

(1)转化缓冲液中试剂的纯度务必使用所能得到的最高质量的试剂,这些试剂应分装成小
份,避光保存于冷处。
(2)细胞的生长状态由于一些不清楚的原因,直接用贮存于-70℃冰冻培养基中的贮存原
种接种而进持培养的细菌,所得到的转化效率最高,不应使用在实验室中连续传代,
贮存于4℃或贮存于室温的培养物。
(3)玻璃和塑料器皿的清洁度痕量的去污剂或其他化学物质的存在可能大大地降低细菌的
生长效率,所以最好拨出一批玻璃器皿专用于制备感受态细菌,而不作它用。
制备感受态细胞时,测OD600 在0.3--0.5之间,空白用无菌体的LB培养基。(菌体的OD600值,JM109或BL21,OD值为0.35,DH5α为0.4,要尽量保证OD值不要过高,更不能超过0.6)
感受态的感受效率最关键的是一个冷字,刚制备的感受态其感受效果最好,但是随着时间的延长感受效果会逐渐下降,所以要将制好的感受态细胞冻存于液氮中,或-70度冰箱保存,这样感受效果才不至下降过快。一般感受态制备好以后24小时其转化效率最高,随后就逐渐下降。一般的宿主菌都不要传代太多,传多了就容易状态不好和污染杂菌。状态好的时候建议冻上一批,用EP管分装好,然后,每次就可以取冻存的菌种来扩增使用。
试剂和用品,非如果有可能,所有的用品(离心管、摇瓶等等)用新的,如果使用旧的,要确保干净。
制备质粒DNA:
碱裂解法小量制备质粒DNA:碱裂解法是基于线性大分子染色体DNA与小分子环形质粒DNA的变性复性的差异达到分离目的的,在pH12.0~12.6的碱性环境中,线型染色体DNA和环型质粒DNA氢键会发生断裂,双链解开而变性,但质粒DNA由于其闭合环型结构,氢
质粒转化 感受态的制备与转化,质粒提取(原理和操作步骤)
天马波波
键仅发生部分断裂,而且其互补链不完全分离;当将pH值调节到中性并在高盐浓度下,已分开的染色体DNA互补链不能复性而交联形成不溶的网状结构,通过离心,大部分染色体DNA、不稳定的大分子RNA和蛋白质-SDS复合物等一起沉淀下来而被除去,而部分变性的闭合环状的质粒DNA在中性条件下很快复性,恢复到原来的构型,呈可溶性状态保存与溶液中,离心后上清中便含有所需要的质粒DNA。[www.61k.com)

1、挑取转化筛选的带有目的质粒的大肠杆菌接种到液体培养基中,37℃震荡培养12~16小
时;
2、将1.5mL菌液加入Ep离心管中,12000 g离心30 Sec,弃上清液,在吸水纸上扣干;
离心时间不能太长,以免影响下一步的菌体悬浮
3、加入100mL预冷的溶液I ,于涡旋振荡器上振荡悬浮细菌细胞,尽量使细胞分散;
溶液I中的葡萄糖的作用是增大让一让的粘度,减少提取过程中的机械剪切力,防止染色体DNA 的断裂;EDTA的作用是与二价离子(Ca2+)结合,降低DNase对DNA的降解。
4、加入200mL新配制的溶液II, 盖紧管口,快速颠倒离心管,以混匀内容物,冰上放置3-5min;
溶液II中的NaOH与SDS可裂解细胞,使DNA变性以及SDS使蛋白变性并形成交联的网状结构
5、加入150ml溶液III, 加盖后颠倒6-7次混匀,冰上放置2~3min;
溶液III为低pH的醋酸钾缓冲液,中和NaOH,以便使部分变性的闭环质粒复性,而细菌染色体DNA不能正确复性
6、12000 g离心6 min,将上清移入另一干净的Ep管中;
7、加2倍上清体积(约1mL)的无水乙醇, 振荡混匀,室温放置2min.
8、12000g离心10min,弃上清液,再用70%的乙醇洗涤一次, 12000g离心1min,离心管倒
置于吸水纸上扣干,然后在中空浓缩系统上干燥质粒;
9、加入40mL含20 mg/mL RNase A的灭菌蒸馏水或TE 缓冲液溶解提取物,室温放置直到质
粒完全溶解(约8min),存于-20℃或直接用于酶切。
质粒图谱:
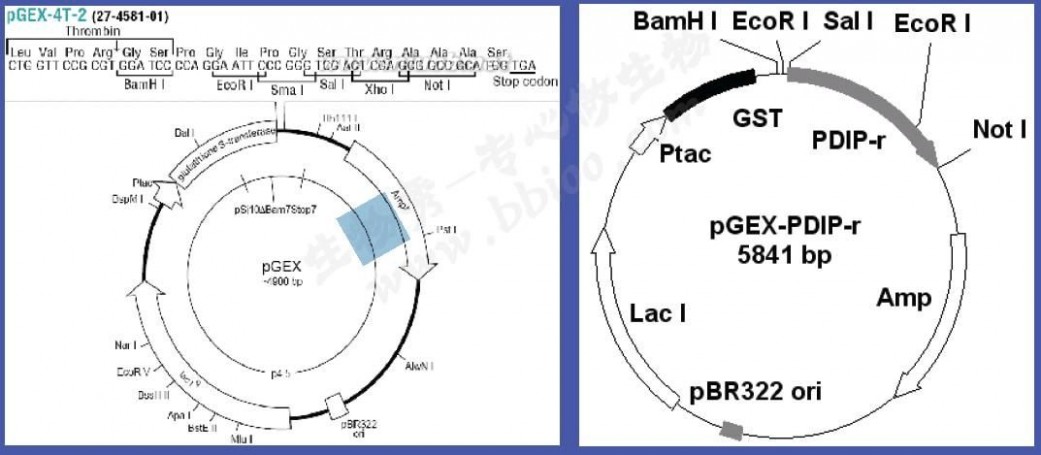
(四)提取质粒的酶切鉴定与琼脂糖凝胶电泳:
1、在0.5mL Ep管中依次加入下列溶液于0.5ml离心管中
质粒转化 感受态的制备与转化,质粒提取(原理和操作步骤)
天马波波
提取质粒DNA 3.0 uL
10× buffer H 1.0 ul
EcoR I 2.0 U
dd H2O 5.8 uL
10 uL
1U: 1单位酶通常定义为,在建议缓冲液及温度下,在20 mL 反应液中反应1h,使1 mg DNA完全消化所需的酶量.
2、轻轻混匀, 4000g离心10秒,置于37℃水浴中酶解1.5h。(www.61k.com)
3、酶解完成后,加入1.2 ml 10×上样缓冲液(或2ml 6×上样缓冲液), 混匀.
4、称取1g琼脂糖,置于三角瓶中,加入100mL0.5×TBE或1×TAE缓冲液,瓶口倒扣一个小
烧杯,将该三角瓶置于微波炉加热直至琼脂糖溶解。
5、将梳子放置在制胶槽上,在冷却至60℃左右的琼脂糖凝胶液加入一小滴EB,小心混匀,
倒到制胶槽上,直到在整个有机玻璃板表面形成均匀的胶层,不要产生气泡(厚度约为3~4mm);
6、室温下静置30min左右,待凝固完全后,轻轻拔出梳子。
7、制好胶后将凝胶连同内槽放在含有0.5×TBE或1×TAE缓冲液的电泳槽中使用(注意:电泳槽中的缓冲液应与配胶用的缓冲液成分、浓度一致)。
8、用微量加样器将样品分别加入胶板的样品孔内加完样后的凝胶板即可通电进行电泳(80~100V的电压下电泳,一般情况下,电压/电极间距离应小于5V/cm),当溴酚兰移动到距离胶板下沿约1cm处停止电泳。
9、在紫外灯(310nm波长)下观察染色后的凝胶。DNA存在处显示出红色的荧光条带(在紫外灯下观察时,应戴上防护眼镜或有机玻璃防护面罩,避免眼睛遭受强紫外光损伤,拍照电泳图谱时,可采用凝胶成象系统)。
本文标题:物质的相互转化和制备-人体的死亡属于物质存在形式的分解和转化61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1