一 : 氟的化学性质除了具有强氧化性,与一些有机物反应烯烃炔烃,还有什么?
氟的化学性质
氟的性质除了具有强氧化性,与一些有机物反应烯烃炔烃,还有什么性质?
氟气的概述、化学性质
一、概述
氟气为浅黄色、剧毒、强腐蚀性气体。具有强烈刺激性特征气味。其沸点为-188.2℃
二、化学性质
氟气是已知的最强的氧化剂。除具有最高价态的金属氟化物和少数纯的全氟有机化合物外,几乎所有有机物和无机物均可以与氟反应。即使是全氟有机化合物,如果被可燃物污染,也可以在氟气氛中燃烧。
氢与氟的化合物异常剧烈,反应生成氟化氢。一般情况下,氧与氟不反应。尽管如此,还是存在两种已知的氧氟化物,即OF2和O2F2。由卤素自身形成的化合物有ClF、ClF3、BrF3、IF5。如上所述,碳或大多数烃与过量氟的反应,将生成四氟化碳及少量四氟乙烯或六氟丙烷。通常,氮对氟而言是惰性的,可用作气相反应的稀释气。氟还可以从许多含卤素的化合物中取代其它卤素。大多数有机化合物与氟的反应将会发生爆炸。
氟气是已知的最强的氧化剂。除具有最高价态的金属氟化物和少数纯的全氟有机化合物外,几乎所有有机物和无机物均可以与氟反应。即使是全氟有机化合物,如果被可燃物污染,也可以在氟气氛中燃烧。
二 : 烯烃的结构特点、化学性质
15周化学辅导(烯烃的结构特点、化学性质)
一、烯烃的结构特点
从乙烯的结构知,乙烯的两个C原子、四个氢原子在同一平面上,如果把乙烯中的四
2个氢原子换成甲基,由于CH2=CH2进行的是SP杂化,所有原子在同一平面上,-CH3却进行
的是SP3杂化,每个C原子处于小四面体的中心,C原子不在同一平面。[www.61k.com]此物质中一定在同一平面的C原子有三个。所以,在烯烃中只有C=C周围原来乙烯的六个原子的位置是一定在同一平面,这往往是考查点,再就是
例1、描述
分子结构的下列叙述中,正确的是:( )
A、有6个碳原子可能都在同一条直线上
B、7个碳原子有可能都在同一平面上
C、有6个碳原子可能在同一平面上
D、不可能有6个碳原子在同一平面上
解析:乙烯的六个原子的位置是一定在同一平面,乙炔的四个原子在同一条直线上。该结构中的后四个原子确实在一条直线上,但三个必定有键角接近与120°,所以A项不正确,而在中双键两边的碳原子共面,而叁键碳两边的碳原子共直线,所以这六个碳原子共面,而甲基的碳原子不能与它们共面。故本题选C。 点拨:乙烯分子中所有原子都在同一平面内,键角为120°。当乙烯分子中某氢原子被其他原子或原子团取代时,则代替该氢原子的原子一定在乙烯的平面内。
二、烯烃主要化学性质
结构决定性质,由烯烃的结构可以得出含有碳碳双键,双键中的∏键容易断裂而发生加成反应,不稳定易被氧化。
1、加成反应
①CH3-CH=CH2 + H2 CH 3 - CH 2 - CH3
②CH3-CH=CH2 + Br2
3-CHBr-CH2Br
③CH3-CH=CH2 + HCl CH3-CHCl-CH3
由反应②得出可使溴水或溴的四氯化碳溶液褪色,此反应可区别烷烃和烯烃。同时还可以用来除杂。反应③符合马氏规则,注意方程式的书写。
例2、除去CH4气体中混有的少量乙烯,选用的最佳试剂是 ( )
A、NaOH溶液 B、溴水 C、浓H2SO4 D、酸性KMnO4溶液
解析:要除掉甲烷中的乙烯,可以运用两者的性质,即能除掉杂质,但又不能带入新的杂质,乙烯不与NaOH溶液和浓H2SO4反应,故排除A、C;可以与溴水反应,并且可以除掉乙烯,B正确;也能与酸性KMnO4溶液反应,但是反应后可生成CO2,有新的杂质生成。故本题选B。
点拨:常运用溴水除杂,也可用来鉴别。
2、氧化反应
(1)可燃性:CnH2n + 3n/2 O2 n CO2 + n H2O
例3、一定量的某烃完全燃烧后,将其生成物通入足量石灰水中,经过滤可以得到10g 第1页
烯烃的化学性质 烯烃的结构特点、化学性质
沉淀,称其滤液质量时,其质量减少3.8g,此有机物可能是 ( )
A.CH4 B.C2H2 C.C2H4 D.C2H6
解析:由题意得燃烧: CnH2n + 3n/2 O2
n CO2 + n H2O后产物通入足量石灰水中会有:
Ca(OH)2 + CO2 =CaCO3 + H2O 质量减少
1mol 100g 56g
n 10g m
n(C)= n(CO2) = 0.1mol
m=(56×10)/100g=5.6g
而实际减少为3.8 g,即该烃完全燃烧后生成水5.6-3.8=1.8 g
故有:n(H)=2n(H2O)=1.8/18mol×2=0.2 mol
n(C):n(H)=0.1:0.2=1:2 符合要求的只有C。[www.61k.com)
点拨:燃烧计算是有机化学中的考查热点,烃的燃烧关键是计算C、H的量,或体积变化来考查。
(2)与KMnO4(H+)溶液的反应:
CH3-CH=CH2CH3-=O + CO2 ↑ + H2O
OH
CH3-=CH-CH3CH3 - =O + O=-CH3
CH3 3 烯烃使高锰酸钾溶液褪色,可以用来鉴别烯烃及除掉析烃,但要注意:当双键在1号位时,会生成CO2。
例4、下列各组中,能用高锰酸钾溶液而不能用溴水鉴别的是: ( )
A、甲烷与乙烯 B、环己烷与环己烯
C、己烷与环己烷 D、1-己烯与2-己烯
解析:A、B项,烯烃与高锰酸钾溶液和溴水均反应,两者可鉴别;C项中高锰酸钾溶液和溴水都不能与己烷与环己烷反应,都不能用来鉴别;D项中两烯烃都与高锰酸钾溶液和溴水反应,但现象不同,1-己烯与高锰酸钾溶液反应会有二氧化碳生成。故本题选D。
点拨:高锰酸钾溶液和溴水都可用来对烯烃鉴别,但反应原理不同,导致出现不同的现象,可根据实际情况对试剂选择。
3、聚合反应:
n CH3-CH=CH2 -CH2n
CH3
n CH2=CH2 + n CH3-CH=CH2 CH2-CH2--CH2n
CH3
加聚反应的实质是:不饱和键的断裂和相互加成,不论加成还是聚合,根本原因都是含有不饱和的C=C双键,该知识点的考查主要是化学方程式的书写、结构单元(链节)及单体的判断。
第2页
烯烃的化学性质 烯烃的结构特点、化学性质
例5、某高聚物的结构式如图, 其单体的名称为: ( )
A、2-甲基-1,3-戊二烯和乙烯
B、2,4-二甲基1,3-已二烯
C、2-甲基-1,3-丁二烯和丙烯
D、2,4-二甲基2-已烯
解析:我们可以运用逐次折键法,如图结构式根据结构将结构单元从右端拆开,断开化学键后,断键还会继续成键,需要断开结构式中双键,依次类推,可以断成2-甲基-1,3-戊二烯和乙烯,故本题选A。(www.61k.com)
点拨:找准链节逐次折键,单体的判断应刃而解。
三、强化练习:
1、乙烯与某烷烃以1:4的体积比混合,其体积在相同条件下是等质量氢气体积的1/26,则该烷烃为 ( )
A、C4H10 B、C3H8 C、C2H6 D、CH4
2、把Mmol H2和N mol C2H4混合,在一定条件下使它们一部分发生反应生成W mol C2H6,将反应后的混合气体完全燃烧,消耗氧的物质的量为 ( )
A、M+3N B、MM7M7+3N C、+3N+W D、+3N—W 22222
3、关于烷烃和烯烃的下列叙述正确的是 ( )
A、符合CnH2n组成的烃不一定是烯烃,而符合CnH2n+2组成的烃一定是烷烃
B、碳原子数相同的烯烃X和烷烃Y,X的同分异构体数目一定比Y多
C、碳原子数相同的烯烃X和烷烃Y,X的含碳量一定比Y高
D、碳原子数相同的烯烃和烷烃,完全燃烧生成二氧化碳的质量一定相同
4、可用于区别乙烯和乙烷的试剂是 ( )
A、酸性高锰酸钾 B、溴水 C、溴化钠溶液 D、浓硫酸
5、写出形成CH2-CH=CH-CH2-CH2--
CH3 n聚合物的单体:
________________________________________________________________。
第3页
三 : 烯烃的化学性质
烯烃的化学性质
烯烃的化学性质很活泼,可以和很多试剂作用,主要发生在碳碳双键上,能起加成、氧化聚合等反应。[www.61k.com)此外,由于双键的影响,与双键直接相连的碳原子(α-碳原子)上的氢(α-H)也可发生一些反应。
一. 加成反应
在反应中π键断开,双键上两个碳原子和其它原子团结合,形成两个σ-键的反应称为加成反应。
( 一) 催化加氢
烯烃在催化剂作用下,低温低压既与氢加成生成烷烃。
RCH=CHR + H2RCH2CH2R
( 二) 亲电加成
在烯烃分子中,由于π电子具流动性,易被极化,因而烯烃具有供电子性能,易受到缺电子试剂(亲电试剂)的进攻而发生反应,这种由亲电试剂的作用而引起的加成反应称为亲电加成反应。
对电子具有亲和力的试剂叫做亲电试剂。亲电试剂由于缺少电子,容易进攻反应物上带部分负电荷的位置,由这类亲电试剂进攻而发生发反应称为亲电反应。亲电试
+剂通常为路易斯酸。如: H Br+、Cl+、H3O+、RC+=O、Cl2、Br2、I2、HCl、HBr、HOCl、
H2SO4、F3C─COOH、BF3、AlCl3等
烯烃的亲电加成反应历程
烯烃的亲电加成反应历程可由实验证明
CH2=CH2Br222
BrBr22
BrCl无22
ClCl实验说明:
1.与溴的加成不是一步,而是分两步进行的。因若是一步的话,则两个溴原子应同时
–加到双键上去,那么Cl就不可能加进去,产物应仅为1,2-二溴乙烷,而不可能有1-氯-2-
–溴乙烷。但实际产物中竟然有1-氯-2-溴乙烷,没有1,2-二氯乙烷。因而可以肯定Cl是在
第二步才加上去的,没有参加第一步反应。
2.反应为亲电加成历程
δ
烯烃的性质 烯烃的化学性质
溴在接近碳碳双键时极化成 ,由于带微正电荷的溴原子较带微负电荷的溴原子
δ
更不稳定,所以,第一步反应是Br+首先进攻双键碳中带微负电荷的碳原子,形成溴鎓离子,第二步负离子从反面进攻溴鎓离子生成产物(反面进攻的证明见P142~144)。(www.61k.com]
HH
δδ
H
H
H

Br
HH
第一步
Br
CH2
BrCH2( Cl )
Cl
Br
第二步
在第一步反应时体系中有Na+、Br+,但Na+具饱和电子结构,有惰性,故第一步只有
δ
Br+参与反应,因而无1,2-二氯乙烷生成。烯烃与各种酸加成时,第一步是H+ 加到双键碳上,生成碳正离子中间体,第二步再加上负性基团形成产物。
δ
CC
H
CH
X
H
X
要明确两点:
1)亲电加成反应历程有两种,都是分两步进行的,作为第一步都是形成带正电的中间体(一种是碳正离子,另一种是鎓离子)。 2)由于形成的中间体的结构不同,第二步加负性基团时,进攻的方向不一样,中间体为鎓离子时,负性基团只能从反面进攻,中间体为碳正离子时,正反两面都可以。


δE
δNu
反面进攻
Et
反式加成产物Nu
E反式加成

(第一步)
E
顺式加成
(第二步)
混合产物
烯烃的性质 烯烃的化学性质
一般Br2, I2通过鎓离子历程,HX等通过碳正离子历程。(www.61k.com]
1) 与HX的加成
CH2=CH2 + HX → CH3CH2-X (HX等通过碳正离子历程)
1° HX的反应活性
HI > HBr > HCl > (HF的加成无实用价值。)
2°不对称烯烃的加成产物遵守马氏规则(有一定的取向,即区位选择性)。 例如:
CH3CH=CH2 + HBr
CH3-C=CH2 + HCl
CH33 + CH3-CH22Br80%(主)20%Br3CH33Cl100%上述两例说明不对称烯烃加HX时有一定的取向,马尔可夫尼可夫总结了这个规律,我们把它称为马尔可夫尼可夫规则,简称马氏规则。
马氏规则 不对称烯烃与卤化氢等极性试剂进行加成时,试剂中带正电荷的部分E+ 总是加到含氢较多的双键碳原子上,试剂中带负电荷的部分(

Nu
键碳原子上。
碳正离子的稳定性顺序为:
CH3
CH3CH3
叔(3°))总是加到含氢较少的双CH3>CH3H仲(2°)H>CH3H伯(1°)>CH3
3° 过氧化物效应
当有过氧化物(如 H2O2, R-O-O-R等)存在时,不对称烯烃与HBr的加成产物不符合
烯烃的性质 烯烃的化学性质
马氏规则(反马氏取向)的现象称为过氧化物效应。(www.61k.com)
例如: 过氧化物
CH3-CH=CH2 + HBr
CH3-CH2-CH2-Br反马氏产物(2)加卤素 CH2=CH2 + Br2
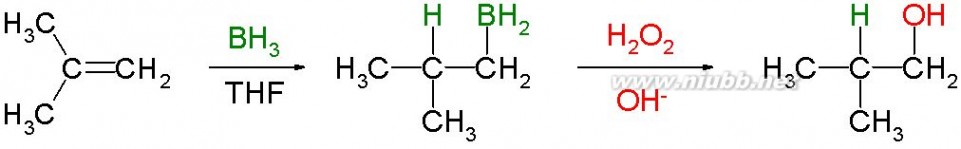
CH2BrCH2Br
将乙烯通入溴的四氯化碳溶液中,溴的颜色很快褪去,常用这个反应来检验烯烃。 (3)加硫酸(加水) 烯烃能与浓硫酸反应,生成硫酸氢烷酯。硫酸氢烷酯易溶于硫酸,用水稀释后水解生成醇。工业上用这种方法合成醇,称为烯烃间接水合法。
CH3CH(OH)CH3 + H2SO4 CH3CH=CH2 + H2SO4 CH3CH(OSO3

H)CH3(4)加次卤酸
烯烃与次卤酸加成,生成β– 卤代醇。由于次卤酸不稳定,常用烯烃与卤素的水溶液反应。如:
CH2=CH2 + HOCl CH2(OH)CH2Cl
5
+ 1 / 2 B2H6CC
HBH2
此反应是用末端烯烃来制取伯醇的好方法,其操作简单,副反应少,产率高。在有机合成上具有重要的应用价值。硼氢化反应是美国化学家布朗(Brown)
与1957年发现的,由此布朗获得了1979年的诺贝尔化学奖。
二、氧化反应
1.用KMnO4或OsO4氧化
1) 用稀的碱性KmnO4氧化,可将烯烃氧化成邻二醇。
3RCH=CH22KMnO44H2O或中性2
OHOH2MnO2KOH
烯烃的性质 烯烃的化学性质
反应中KMnO4褪色,且有MnO2沉淀生成。(www.61k.com)故此反应可用来鉴定不饱合烃。 此反应生成的产物为顺式-1,2-二醇,可看成是特殊的顺式加成反应。
也可以用OsO4代替KMnO4进行反应,见P61。
2)用酸性KMnO4氧化
在酸性条件下氧化,反应进行得更快,得到碳链断裂的氧化产物(低级酮或羧酸)。 KMnOH2SO4R-CH=CH2R-COOH羧酸
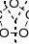
CO2 + H2O
RCHR''KMnORO
酮

R

1HR2SO4R''-COOH羧酸
2° 制备一定结构的有机酸和酮,
3° 推测原烯烃的结构。
2.臭氧化反应(用含有臭氧6~8%的氧气作氧化剂)
将含有臭氧(6~8%)的氧气通入液态烯烃或烯烃的四氯化碳溶液,臭氧迅速 而定量地与烯烃作用,生成臭氧化物的反应,称为臭氧化反应。
RR'R''HR''R'HRROOR''HO3H2O2臭氧化物粘糊状,易爆炸,不必分离,
可直接在溶液中水解。2O
为了防止生成的过氧化物继续氧化醛、酮,通常臭氧化物的水解是在加入还原剂(如Zn / H2O)或催化氢化下进行。
例如:
1) O2) Zn/H2OCH33CH3CH3CH3COCH3CHO乙醛丙酮
烯烃的性质 烯烃的化学性质
烯烃臭氧化物的还原水解产物与烯烃结构的关系为:
烯烃结构 臭氧化还原水解产物
CH2= HCHO(甲醛)
RCH= RCHO(醛)
R2C= R2C=O(酮)
故可通过臭氧化物还原水解的产物来推测原烯烃的结构。[www.61k.com]
例如:
臭氧化还原水解产物,
CH3COCH3 OCHCH2CHO HCHO,
原烯烃的结构
3CH3CH


3OCH3CH3-C-CH2CHCH2CHOCH32CH=CH2
3.催化氧化
某些烯烃在特定催化剂存在下能被氧化生成重要的化工原料:
此类反应是特定反应,不能泛用。例如,如要将其它烯烃氧化成环氧烷烃,则要用过氧酸来氧化。
CH3CH=CH2CH3CH32
CH3COOH

四、聚合反应
烯烃在少量引发剂或催化剂作用下,键断裂而互相加成,形成高分子化合物的 反应称为聚合反应。
例如,乙烯的聚合 少量引发剂高压聚乙烯
高压法

n CH2=CH2
乙烯
(单体)2-CH2150~250℃150~300Mpa聚乙烯(高分子)
低压法TiCl4 2H5)3低压聚乙烯
烯烃的性质 烯烃的化学性质
聚乙烯是一个电绝缘性能好,耐酸碱,抗腐蚀,用途广的高分子材料(塑料)。(www.61k.com)
TiCl4 2H5)3 nCH3CH=CH2
50℃10Mpa2CH3

聚丙烯
TiCl4-Al(C2H5)3 称为齐格勒(Ziegler 德国人)、纳塔(Natta 意大利人)催化剂。1959年齐格勒 纳塔利用此催化剂首次合成了立体定向高分子,人造天然橡胶。为有机合成做出了具大的贡献。为此,两人共享了1963年的诺贝尔化学奖。
五、α-H(烯丙氢)的卤代反应
双键是烯烃的官能团,凡官能团的邻位统称为α位,α位(α碳)上连接的氢原子称为α- H(又称为烯丙氢)。α- H由于受C=C的影响,αC-H键离解能减弱。
.故α- H比其它类型的氢易起反应。其活性顺序为:
α- H(烯丙氢)> 3°H > 2°H > 1°H > 乙烯H
有α- H的烯烃与氯或溴在高温下(500~600℃),发生α- H原子被卤原子取代的反应而不是加成反应。
例如:
Cl2CH3-CH=CH2 + Cl2CH2-CH=CH2 + HClClCl+ HCl
烯烃的性质 烯烃的化学性质
卤代反应中α- H的反应活性为:3°α- H > 2°α- H > 1°α- H 例如:
3CH
CH3CH-CH=CH-CH3Br2(1mol)CH3CH33
Br
主要产物CH3CH32Br次要产物
高温下发生取代而不是加成的原因:
高温时反应为自由基取代历程。[www.61k.com)
Cl2 2Cl?
HCl + ?CH2CH=CH2
CL-CH2CH=CH2 CH3CH=CH2 + Cl??CH2CH=CH2 + Cl2
当烯烃在温度低于250℃时与氯反应,则主要是进行加成反应。
本文标题:烯烃的化学性质-氟的化学性质除了具有强氧化性,与一些有机物反应烯烃炔烃,还有什么?61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1