一 : 空气动力学基础知识
二 : 反应动力学基础
2 反应动力学基础
2.1在一体积为4L的恒容反应器中进行A的水解反应,反应前 A的含量为12.23%(重量),混合物的密度为1g/mL,反应物A的分子量为88。[www.61k.com)在等温常压

解:利用反应时间与组分A的浓度变化数据,作出CA~t的关系曲线,用镜
面法求得t=3.5h时该点的切线,即为水解速率。
切线的斜率为
由(2.6)式可知反应物的水解速率为 ????0.125mol/l.h6.1
r?A?dCdt?0.125mol/l.h
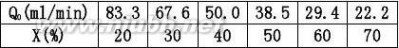
2.2在一管式反应器中常压300℃等温下进行甲烷化反应:
催化剂体积为10ml,原料气中CO的含量为3%,其余为N2,H2气体,改变进口原
料气流量Q0解:是一个流动反应器,其反应速率式可用(2.7)式来表示 CO?3H2?CH4?H2O
rA??dFA
dVR
FA?FA0(1?XA)?Q0CA0(1?XA)dFA??Q0CA0dXA
故反应速率可表示为:
用XA~VR/Q0作图,过VR/Q0=0.20min的点作切线,即得该条件下的dXA/d(VR/Q0)值α。
dXAdXArA?Q
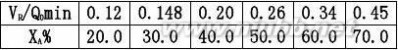
0CA0?CA0RR0
???1.79故CO的转化速率为
P?6.38?10?4mol/lCA0??RT8.314?10?3?573
反应动力学 反应动力学基础
rA?CA0
2.3已知在Fe-Mg催化剂上水煤气变换反应的正反应动力学方程为:
式中yCO和yCO2为一氧化碳及二氧化碳的瞬间摩尔分率,0.1MPa压力及700K时反
应速率常数kW等于0.0535kmol/kg.h。[www.61k.com)如催化剂的比表面积为30m2/g,堆密度为
1.13g/cm3,试计算:
(1) (1) 以反应体积为基准的速率常数kV。
(2) (2) 以反应相界面积为基准的速率常数kg。
(3) (3) 以分压表示反应物系组成时的速率常数kg。
(4) (4) 以摩尔浓度表示反应物系组成时的速率常数kC。
解:利用(2.10)式及(2.28)式可求得问题的解。注意题中所给比表面的单位换算成m2/m3。 0.85?0.4r?kwyCOyCO2kmol/kg?hdXA?6.38?10?4?1.79?1.14?10?3mol/l.minR0
(1)kv??bkw?1.13?103?0.0535?60.46kmol/m3.h
(2)kg??avkw???b?30?10?6kmol/m2.hk?1.78?103w
(3)kp?()nkw?()0.45?0.0535?0.1508P0.1013kg.h.(MPa)0.45
?33n0.45(4)kc?()kw?()?0.0535?0.333()0.45()P0.1kmolkg.h
2.4在等温下进行液相反应A+B→C+D,在该条件下的反应速率方程为: 若将A和B的初始浓度均为3mol/l的原料混合进行反应,求反应4min时A的转化率。
解:由题中条件知是个等容反应过程,且A和B的初始浓度均相等,即为
1.5mol/l,故可把反应速率式简化,得
由(2.6)式可知
?d?C(1?X)?dCAdXA??A0A??rA????CA0dtdtdt 0.5rA?0.8C1.5CABmol/l?min 0.5222rA?0.8C1.5C?0.8C?0.8C(1?X)ABAA0A
代入速率方程式
CA0
化简整理得 dXA22?0.8CA0(1?XA)
积分得 dXA?0.8CA0dtA
0.8CA0t?
解得XA=82.76%。 X1?XA
反应动力学 反应动力学基础
2.5氨合成塔入口的气体组成为3.5%NH3,20.8%N2,62.6%H2,7.08%Ar及
5.89CH4。[www.61k.com]该塔是在30MPa压力下操作。已知催化剂床层中某处的温度为490℃,反应气体中氨含量为10%(mol),试计算该处的反应速率。在Fe催化剂上氨合成反应速率式为:
pNH3 ??4逆反应的活化能E?17.58?10J/mol。450℃时
2k2?2277m3(MPa)0.5/m3?h,且k1/k2?KP,490℃时,Kp可按下式计算: r?k1pN2p1.5H2?k2pNH33kmol/m?h1.5pH2
logKp?2047.8/T?2.4943logT?1.256?10?4T?1.8564?10?7T2?3.206注:m为标准立方米。
解:题中给出450℃时的k2值,而反应是在490℃下,故首先要求出490℃
时的k2值。
利用(2.27)试,求出频率因子A: 3
490℃的Kp值由题给公式计算出 ??k2?Aexp()RT???17.58?104/8.314?723A?k2exp()?2277/e?1.145?1016??'16?17.58?104/8.314?723k2?Aexp()?1.145?10e?1.055?104m3(MPa)0.5/m3.hlogKp?2047.8/763?2.4943log763?1.256?10?4?763?1.8564?10?7?7632????????????3.206??1.2524
Kp?5.592?10?2
求k1值:
K2
p?k1
'k2'k1?K2kp2
求各组分的分压值: k1?(5.592?10?2)2?1.055?104?33m3(MPa)?1.5/m3.h
N?H?NH32222
反应动力学 反应动力学基础
?ipA0XA?Api?1?yA0?AXApi0?
?iyA0XA?Ayi?, pi?yiP1?yA0?AXAyi0?
131+)=-2yA0?20.87% , ?A=1
2
?yR0?RyA0XA?AyR?1?yA0?AXA
0.035?
0.10?1*0.2087*XA?1?0.2087*(-2)*XA
45.914XA?6.5
XA?0.1416
yA?
?yA0?yA0XA1?yA0?AXA0.2087(1-0.1416)
1?0.2087*(-2)*0.1416
?0.1904
3yH0?yA0XAyH?1?yA0?AXA
0.626-3*0.2087*0.1416=0.57161?0.2087*(-2)*0.1416
pi?yiP

反应速率为: ?
r?k1pN2p1.5H2pNH3?k2pNH3p1.5H21.5?33.0?5.718??1.055?104?317.151.5
?4.023?103m3/m3cat.h(179.6kmol/m3cat.h)
2.6下面是两个反应的T-X图,图中AB是平衡曲线,NP是最佳温度曲线,
反应动力学 反应动力学基础
AM是等温线,HB是等转化率线。(www.61k.com)根据下面两图回答:

(1) (1) 是可逆反应还是不可逆反应?
(2) (2) 是放热反应还是吸热反应?
(3) (3) 在等温线上,A,D,O,E,M点中哪一点速率最大,哪一点速率最小?
(4) (4) 在等转化率线上,H,C,R,O,F及B点中,哪一点速率最大,哪一点
速率最小?
(5) (5) 在C,R两点中,谁的速率大?
(6) (6) 根据图中所给的十点中,判断哪一点速率最大?
解: 图2.1 图2.2
(1)可逆反应 可逆反应
(2)放热反应 吸热反应
(3)M点速率最大,A点速率最小 M点速率最大,A点速率最小
(4)O点速率最大,B点速率最小 H点速率最大,B点速率最小
(5)R点速率大于C点速率 C点速率大于R点速率
(6)M点速率最大 根据等速线的走向来判断H,M点的速率大小。
2.7在进行一氧化碳变换反应动力学研究中,采用B106催化剂进行试验,测得正反应活化能为9.629?10J/mol,如果不考虑逆反应,试问反应温度是550℃时的速率比反应温度是400℃时的速率大多少倍?
解:从题中可知,反应条件除了温度不同外,其它条件都相同,而温度的影响表现在反应速率常数k上,故可用反应速率常数之比来描述反应速率之比。 4
r550k550?400400
2.8常压下,在钒催化剂上进行SO2氧化反应,原料气组成为7%O2及82%N2。试计算转化率为80%时的最佳温度。二氧化硫在钒催化剂上氧化的正反应活化能为9.211?10J/mol,化学计量数等于2,反应式为: 4Aexp()(?)(?)RT550400550??e?e8.314673823?23(倍)Aexp()RT400
其平衡常数与温度的关系为: SO2?O2?SO32
logKp?4905.5/Te?4.6455
反应动力学 反应动力学基础
该反应的热效应?Hr?9.629?10J/mol。[www.61k.com]
解:(1)求出转化率为80%时各组分的分压:

4
pSO2?PySO2?0.1013?1.4/97.2?1.46?10?3(MPa)
pO2?PyO2?0.1013?8.2/97.2?8.55?10?3(MPa)
pSO3?PySO3?0.1013?5.6/97.2?5.84?10?3(MPa)
pN2?PyN2?0.1013?82/97.2?8.55?10?2(MPa)
(2)求与上述组成对应的平衡常数KP值:
KP?pSO3
0.5pSO2po2?3??43.26?3??3?0.51.46?10?8.55?10???
(3)求平衡温度Te
logKp?4905.5/Te?4.6455
Te??780.9K
(4)利用(2.31)式求逆反应活化能E值
(5)利用(2.31)式求最佳温度TOP ????44E?E??9.211?10??1.403?105J/molr2
e??739.004Ke1?ln1?ln4(14.03?9.211)?10E?EE TOP?
2.9在一恒容反应器中进行下列液相反应:
3r?1.6Ckmol/m?h A?B?R RA
232A?D rD?8.2CAkmol/m?h
式中rR,rD分别表示产物R及D的生成速率。反应用的原料为A与B的混合物,
其中A的浓度为2kmol/m3,试计算A的转化率达到95%时所需的反应时间。
解:反应物A的消耗速率应为两反应速率之和,即
利用(2.6)式 2RA?rR?2rD?1.6CA?16.4CA?1.6CA(1?10.25CA)
?
积分之 dCA?1.6CA(1?10.25CA)
反应动力学 反应动力学基础
2.10在催化剂上进行三甲基苯的氢解反应: ?(1?X)??AA0??CA1.6t??CA0?(?)dCA??ln(1?XA)?ln??CA10.25CA?11???A0??t?0.6463/1.6?0.4038h
反应器进口原料气组成为66.67%H2,33.33%三甲基苯。[www.61k.com)在0.1Mpa及523K下等温
反应,当反应器出口三甲基苯的转化率为80%时,其混合气体的氢含量为20%,试求:
(1) (1) 此时反应器出口的气体组成。
(2) (2) 若这两个反应的动力学方程分别为:
0.5rA?6300CACBkmol/m3?h
0.5rE?3400CCCBkmol/m3?h C6H3(CH3)3?H2?C6H4(CH3)2?CH4 C6H4(CH3)2?H2?C6H5CH3?CH4
则出口处二甲基苯的生成速率是多少?
解:以100mol为计算基准,设X为三甲基苯的转化率,Y为生成的甲苯摩尔数。
(1) (1)
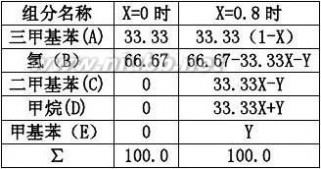
66.67-33.33X-Y=20
解得Y=66.67-33.33×0.8-20=20.01kmol(甲苯量)
生成的二甲基苯量:33.33×0.8-20.01=6.654kmol
生成的甲烷量:33.33×0.8+20.01=46.67kmol
剩余的三甲基苯量:33.33×(1-0.8)=6.666kmol
氢气含量为:20kmol
故出口尾气组成为:三甲基苯6.666%,氢气20%,二甲基苯6.654%,甲烷46.67%,甲基苯20.01%。
(2) (2) 由题给条件可知,三甲基苯的出口浓度为:
pA0?33??7.669?10kmol/mRT8.314?10?3?523
CA?CA0(1?0.8)?7.669?10?3(1?0.8)?1.534?10?3kmol/m3 CA0?
反应动力学 反应动力学基础
0.50.5RC?rA?rE?6300CACB?3400CCCB?1.534?10?3?4.6?10?3kmol/m3CC??1.534?10?3?1.532?10?3kmol/m30.06666CD??1.534?10?3?1.074?10?3kmol/m30.06666CE??1.534?10?3?4.603?10?3kmol/m3 CB?
?6300?1.534?10?3?(4.6?10?3)0.5?3400?1.532?10?3?(4.6?10?3)0.5?0.6555?0.3533?0.3022kmol/m3.h
2.11在210℃等温下进行亚硝酸乙脂的气相分解反应:
该反应为一级不可逆反应,反应速率常数与温度的关系为 C2H5NO2?NO?CH3CHO?C2H5OH22
k?1.39?1014exp(?1.897?104/T)(s?1),若反应是在恒容下进行,系统的起始总压为0.1013MPa,采用的是纯亚硝酸乙脂,试计算亚硝酸乙脂分解率为80%时,亚硝酸乙脂的分解速率及乙醇的生成速率。[www.61k.com)
若采用恒压反应,乙醇的生成速率又是多少?
解:(1)恒容过程,其反应式可表示为:
反应速率式表示为: A?B?C?D22
设为理想气体,反应物A的初始浓度为: rA?kCA?kCA0(1?XA)
CA0?Py?2??2.523?10mol/l?38.314?10?483
rA?kCA0(1?XA)?1.39?1014exp(?18973/T)?CA0(1?XA)
?1.39?1014exp(?18973/483)?2.523?10?2?(100.8)?6.112?10?6mol/l.s 亚硝酸乙脂的分解速率为:
乙醇的生成速率为: RA?rA?6.112?10?6mol/l.s
RD?rA?3.056?10?6mol/l.s2
(2)恒压过程,由于反应前后摩尔数有变化,是个变容过程,由(2.49)式可求得总摩尔数的变化。
?A???t/?A??11
由于反应物是纯A,故有:yA0=1。
由(2.52)式可求得组分的瞬间浓度:
反应动力学 反应动力学基础
CA0(1?XA)2.523?10?2(1?0.8)CA???2.803?10?2mol/l1?AyA0XA1?1?1?0.8
rA?kCA?1.39?1014exp(?18973/483)?2.803?10?2?3.395?10?6mol/l.s乙醇的生成速率为:
2.12甲烷与水蒸气在镍催化剂及750℃等温下的转化反应为:
原料气中甲烷与水蒸气的摩尔比为1:4,若这个反应对各反应物均为一级,已知k=2l/mol.s,试求:
(1) (1) 反应在恒容下进行,系统的初始总压为0.1013MPa,当反应器出口
的CH4转化率为80%时,CO2和H2的生成速率是多少?
(2) (2) 反应在恒压下进行,其他条件如(1),CO2的生成速率又是多少?
解:(1)由题意可将反应速率表示为: 1RD?rA?1.698?10?6mol/l.s2 CH4?2H2O?CO2?4H2
A?2B?C?4D
对于恒容过程,则有 rC?kCACB
CA?CA0(1?XA)
CB?CB0?2CA0XA
PA00.1013?0.2?3??2.382?10mol/l?3RT8.314?10?1023
CB0?4CA0?4?2.382?10?3?9.528?10?3mol/l CA0?
当XA0=0.8时
CA?CA0(1?XA)?2.382?10?3?0.2?4.764?10?4mol/l
CB?CB0?2CA0XA?9.528?10?3?2?2.382?10?3?0.8?5.717?10?3mol/lRC?rC?kCACB?2?4.764?10?4?5.717?10?3?5.447?10?6mol/l.sRD?4rC?4?5.447?10?6?2.179?10?5mol/l.s
(2)对于恒压过程,是个变容反应过程,由(2.49)式可求得总摩尔数的变化
?A???t/?A??2
反应物A的原始分率:
yA0?
由(2.52)式可求得转化率为80%时的浓度: 1?0.21?4
C(1?X)2.382?10?3(1?0.8)CA???3.609?10?4mol/l1?AyA0XA1?2?0.2?0.8
CB0?2CA0XA9.528?10?3?2?2.382?10?3?0.8CB???4.331?10?5mol/lAA0A1?2?0.2?0.8
反应动力学 反应动力学基础
rA?kCACB?2?3.609?10?4?4.331?10?5?3.126?10?6mol/l.sRC?rC?3.126?10?6mol/l.s
2.13在473K等温及常压下进行气相反应:
(1)A?3R rR?1.2CAmol/l?min
(2)A?2S rS?0.5CAmol/l?min
(3)A?T rT?2.1CAmol/l?min
式中CA为反应物A的浓度(mol/l),原料中A和惰性气体各为一半(体积比),
试求当A的转化率达85%时,其转化速率是多少?
解:方法(1),先求出总摩尔变化数?A。[www.61k.com)
首先将产物的生成速率变为对应的反应物的转化速率:
1rAR?rR?0.4CA3
1rAS?rS?0.25CA2
rAT?rT?2.1CA
总反应速率为:
以一摩尔反应物A为基准,总摩尔变化数为: RA?rAR?rAS?rAT?2.75CA
?A?
初始浓度为: 0.40.252.1?3??2??1?0.3822.752.752.75
则有 Py0.1013?0.5?2CA0???1.288?10mol/l?3RT8.314?10?473
CA0(1?XA)1.288?10?2?0.15CA???1.6625?10?3mol/l1?AyA0XA1?0.5?0.38?0.85
方法(2),可将CA表示为: RA?2.75CA?2.75?1.6625?10?3?4.572?10?3mol/l.min
CA0(1?XA)CA?1?yA0?AjXAj
?AR?
?AS
?AT3?1?212?1??11?0
反应动力学 反应动力学基础
方法(3),利用物料衡算可分别求出反应物A生成R及S的瞬间选择性SR,SS,因而可求出产物R及S的收率yR,yS,求得A转化率为85%时的分率: 0.40.25?0.85?1??0.85?0.32452.752.751.288?10?2?0.15CA??1.6623?10?3mol/l1?0.3245?0.5RA?2.75CA?2.75?1.6623?10?3?4.571?10?3mol/l.min ??AjXAj?2?
yA?yA0(1?yR?yS?yT)?0.06453A0RA0S
CA?2CAOyA?1.288?10?2?0.06453?2?1.6623?10?3mol/lRA?2.75CA?2.75?1.6623?10?3?4.571?10?3mol/l.min其中:
SR?0.4CA0.4?(0.4?0.25?2.1)CA2.75
0.25C0.25SS??(0.4?0.25?2.1)CA2.75
0.4?0.85?0.12362.75
0.25yS??0.85?0.077272.75yR?
2.14在Pt催化剂上进行异丙苯分解反应:
以A,B及R分别表示异丙苯,苯及丙烯,反应步骤如下:
(1)A???A?
(2)A??B??R
(3)B??B??
若表面反应为速率控制步骤,试推导异丙苯分解的速率方程。[www.61k.com)
解:根据速率控制步骤及定态近似原理,除表面反应外,其它两步达到平衡,描述如下: C6H5CH(CH3)2?C6H6?C3H6
A???A?
A??B??RKA?pA?V
B??B??
??rA?k?A?kpR?B ??rA?k?A?kpR?B p?KB??B?KBpB?V?A?A?KApA?V?B以表面反应速率方程来代表整个反应的速率方程:
反应动力学 反应动力学基础
由于?A??B??V?1
将?A,?B代入上式得:
KApA?V?KBpB?V??V?1
整理得:
?V?1
1?KApA?KBpB
将?A,?B,?V代入速率方程中 ??kKApAkpRKBpBk(pA?pBpR)/KPrA???1?KApA?KBpB1?KApA?KBpB1?KApA?KBpB 其中 ???k?kKAKP?kKA/kKB
2.15在银催化剂上进行乙烯氧化反应:
2C2H4?O2?2C2H4O
化作2(A)?(B2)?2(R)
其反应步骤可表示如下:
(1)A???A?
(2)B2?2??2B?
(3)A??B??R???
(4)R??R??
若是第三步是速率控制步骤,试推导其动力学方程。[www.61k.com]
解:根据速率控制步骤及定态近似原理,除表面反应步骤外,其余近似达到平衡,写出相应的覆盖率表达式:
整个反应的速率方程以表面反应的速率方程来表示:
根据总覆盖率为1的原则,则有:
或 ?A?KA
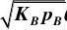
p?(2)B2?2??2B??B?V (4)R??R???R?KRpRV ??rA?k?A?B?k?R?V (1)A???A??A??B??R??V?
1
KApA?V?

V?KRpR?V??V?1
整理得:
?V?
将?A,?B,R,V代入反应速率方程,得:
反应动力学 反应动力学基础

??22rA?kKApV?kpRKR?V?
其中

?K?k/kKR
2.16设有反应?B?D,其反应步骤表示如下:
(1)A???A?
(2)A??B??D
(3)B??B?? ?k?kK若(1)速率控制步骤,试推导其动力学方程。(www.61k.com]
解:先写出各步的速率式:
(1)A???A?
(2)A??B??D
(3)B??B??r1?kaApA?V?kdA?Ar2?kS?A
r3?kdB?B?kaBpA?V
由于(1)是速率控制步骤,第(2)步是不可逆反应,其反应速率应等于(1)的吸附速率,故有:
整理得: kaApA?V?kdA?A?kS?A
?A?
根据定态近似原则 kp?kS?kdA
d?B?kS?A?kdB?B?kaApA?V?0dt
kkpkdB?B?kS?A?kaApA?V?(SaAA?kaBpB)?VkS?kaA
kSkaApA?kaBpB)?V/kdBkS?kaA
因为?A??B??V?1 ?B?(
将?A,?B代入上式,化简后得:
?V?
1?1?KBpBkS?kdA
最后将?A,?V代入吸附速率式,即为该反应的动力学方程式。
kaApA?kdA
r1?
1?kaApAkS?kdAkaApA?KBpBkS?kdA?kSkaApAkS?kdA?kaApA?(kS?kdA)KBpB
反应动力学 反应动力学基础
2.17一氧化碳变换反应:
在较低温度下,其动力学方程可表示为: CO(A)?H2O(B)?CO2(C)?H2(D)
r?kpp1?KApA?KCpC
试拟定该反应的合适的反应步骤。(www.61k.com)
解:根据题意,假设反应步骤如下:
并假设第二步是控制步骤,其速率方程就代表了整个反应的速率方程: 其余的两步可认为达到平衡,则有: (1)A???A?(2)A??B?C??D(3)C??C?? r?kS?ApB
?A?KApA?V
?C?KCpC?V
由于?A??B??V?1,有:
?V?1
1?KApA?KCpC
将?A,?V代入速率式,得:
kKppkpp?1?KApA?KCpC1?KApA?KCpC
式中k?kSKA。故上述假定与题意符合。但上述假定的反应步骤不是唯一的。 r?
2.18利用习题2.1的数据,试用积分法和微分法求其动力学方程。 解:先用积分法求其动力学方程。
设为一级不可逆反应,其速率表达式为:
rA??
积分得: dC?kCAdt
CA0kt?ln()CA
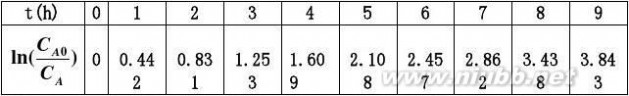
Cln(A0)CA
反应动力学 反应动力学基础
表示为:
rA??
用微分法求解动力学方程
首先用CA~t曲线,在曲线上取时间为0,1,2,……9h所对应点的切线,为了
准确可采用镜面法,求得各切线的斜率即为对应的dCA/dt之值,然后再以
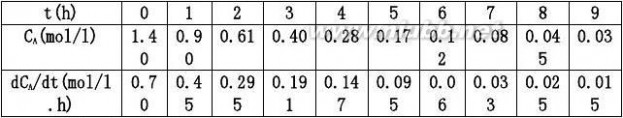
AA方程可表示为: dC?0.425CAmol/l.hdt
或将速率方程直线化,即两边取对数,得: dCrA???0.5CAmol/l.hdt
ln(?dCA)?lnk?nlnCAdt

可简化为y=b+ax形式,利用多元回归,可求得反应级数n=1.004≈1,反应速率常数值为k=0.4996。(www.61k.com]
还可用一数学公式来拟合CA~t曲线,然后再将该数学公式对t求导,求得dCA/dt之值,此法会比作图法来的准确。
2.19在Ni催化剂上进行甲烷化反应:
CO?3H2?CH4?H2O
数及正反应速率常数。
解:由题意可写出速率方程式:
但由于氢的分压保持为0.1013MPa的恒定值,反应速率式可简化为:
arCH4?kpCOa?rCH4?k'pCOpH2
式中k?k'pH2?。将速率式直线化:
反应动力学 反应动力学基础
lnrCH4?lnk?alnpCO
CH4
式中
系数计算式:
或y?b?ax
,由残差平方和最小而导出最小二乘法的
y?lnr
,b?lnk,x??lnpCO
xy?mxya?
???x???m?x
2
2
b?
1?y?a?x????m
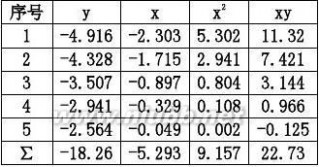
将累加值代入a,b(?18.26)?(?5.293)?5?22.73a??0.957?12
(?5.293)?5?9.1571
b???18.26?0.957?(?5.293)???2.639
5
k?7.144?10?2
RCH4?rCH4?7.144?10?2pCOkmol/g.min
kpp(1?KBpB)2
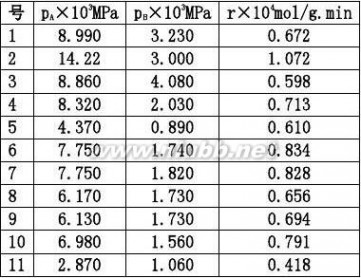
2.20在铂催化剂上,乙烯深度氧化的动力学方程可表示为:
r?
式中pA,pB
反应动力学 反应动力学基础
试求该温度下的反应速率常数k和吸附平衡常数KB。[www.61k.com]
解:首先将动力学方程式直线化:

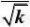
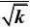
r?
kpApB
?2
(1?KBpB)
或y=b+ax。其中
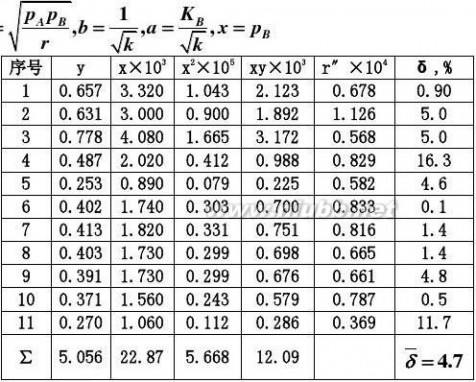
??pB
y
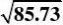
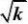
2.287?10?5.056?11?1.209?10a??169.12?4?5
2.287?10?11?5.688?101?2
?b??5.056?169.1?2.287?10?0.108??11
1
k?2?85.73
bKB??169.1??1.566?103r?
85.73pp?1?1.566?10
3
pB
?
2
平均偏差??4.7%,结果是令人满意的。
三 : 空气动力学基础(北航精品课程)-刘沛清
四 : 《空气动力学学报》:《空气动力学学报》-基本信息,《空气动力学学报》
《空气动力学学报》的杂志名称是《空气动力学学报》双月刊,全年零售价是180元/年。每期零售价是30.00元/期。主办单位是中国空气动力学会、中国空气动力研究与发展中心。编辑出版是空气动力学学报编辑部。国内统一刊号是CN51-1191/V。邮发代号是62-27。联合征定代号是LD511191。报刊版式是16开。
《空气动力学学报》1980年创刊,1983年国内外公开发行,是中国空气动力学会主办的国家综合性一级学术刊

空气动力学学报_《空气动力学学报》 -基本信息
杂志名称:《空气动力学学报》季刊
全年零售价:180元/年
每期零售价:30.00元/期
主办单位:中国空气动力学会、中国空气动力研究与发展中心
编辑出版:空气动力学学报编辑部
国内统一刊号:CN51-1191/V
邮发代号:62-27
联合征定代号:LD511191
报刊版式:16开
空气动力学学报_《空气动力学学报》 -企业概况信息
“《空气动力学学报》自2004年开始被EiComnendex数据库收录。”近日,《空气动力学学报》编辑部收到美国工程信息公司(Ei)寄来的证书。中国科学院院士张涵信表示:“加入美国Ei核心数据库,是科技期刊学术水平高、影响力大、实力强的重要标志,是科技期刊走向世界、扩大国际影响力、加强国际交流的重要途径。”
美国Ei核心数据库是世界公认的权威工程科学数据库。目前我国4800多种期刊中,只有10七种被其收录。《空气动力学学报》由中国空气动力学学会主办,是1种基础性和高科技学术期刊,创刊于1980年,为季刊。主要刊登空气动力学学科的理论、技术、实验和应用研究中的最新成果、进展及研究综述,发表流体力学、风工程等论文,开展学术讨论。期刊由著名科学家庄逢甘院士担任主编。
由于编委及广大科技工作者的支持,《空气动力学学报》的稿源一直比较丰富。据近5年来不完全统计,《学报》共组稿610多篇,发表论文384篇,发表率为59%。这些论文来自国内外30多个科研、院校、设计、生产单位,几乎包括了国内所有从事气动力学研究的单位和大多数研究人员。其中很多论文是我国航空航天研究的前沿重大课题,“八五”、“九五”重大攻关课题和国家自然科学基金、863基金、921课题,航空科学基金,国家教委基金课题等。据编辑部统计,其中论文项目获部委级一等奖的重大课题有10多项,二等奖40多项、三等奖20多项。有863高技术项目10多项,国家自然科学基金项目70多项、航空航天基金项目80多项。2000年我们在中国科学技术信息所出版的“中国科技期刊引证报告”中查出,《空气动力学学报》发表的论文,在1999年的总被引频次为111次,基金项目比为38%。这些论文的研究内容,有很高的学术水平和应用价值,有的在国内外都得到了公认,如获国防科工委一等奖的“NND差分计算格式及其求解应用”研究项目系列论文,从“中国科技论文统计与分析”系统查出,1999年就被国内多种期刊引用8次之多。《空气动力学学报》特别重视稿件内容的创新,解决气动力学前沿研究问题,如:
(1)重视气动力学研究中流动机理新概念、新方法的研究。如“分离流和涡”、“湍流模型”、“大攻角流动特性”、“非定常动稳定性特性”、“大攻角气动特性与飞行力学的相关性”等等的研究。我们每年几乎都要出专辑、增刊,以及时给读者传播这些研究领域的信息。
(2)重视在航天航空高技术研究中,飞行器在高超音速、超音速、低速冷热环境下用空气动力学3大研究手段获得的气动力,气动热和气动物理特性的研究方法,结果及应用,特别是很有价值的计算与实验相结合的研究。如“921”项目的热流计算和喷流实验,风洞模型的动特性实验,分离流中旋涡运动的热行为及其控制的数值模拟等……我们都能及时报道。
(3)能注意刊载航天航空气动研究中新开发的应用性好的各种外形的数值软件方法。如曾获得国防科工委一等奖的飞机、再入弹头,战术弹3大软件系统的研究方法应用论文,该项目应用于歼七、歼十、921、863项目及各种海防,地空导弹的设计,直接为型号武器,为国防建设服务,创造了较大的经济效益。
几年来《空气动力学学报》的出版工作,已经从传统落后的手工作业迈上了现代化的出版行列,这对于提高编辑出版质量、提高学术水平和缩短出版周期以及与国内外同行的接轨有很大的意义,几年来我们:
(1)基本上实现了期刊编排、作图电子化。作者用软盘投稿,或发E-mail稿件,实行编排微机化,一体化。保证了期刊的编校质量、缩短了出版周期,保证了期刊的按时出版。从过去的稿件积压1年半发表,到现在的1年发表。
(2)已有了电子版刊物。《空气动力学学报》通过清华大学科技期刊光盘版出版了电子刊物,面向国内外及港台地区发行。电子出版物信息量大、存储内容多,易于使用,方便广大读者和作者的查阅。
(3)通过中国信息研究所的万方数据库,《空气动力学学报》已经进入了国际互联网,成为网上重要的电子出版物,有互联网服务,提高了期刊的利用率和共享水平。
空气动力学学报_《空气动力学学报》 -栏目信息
主要刊载空气动力学领域具有创造性的理论、实验和应用研究论文、综述性专论文及研究简报、学术讨论等。
空气动力学学报_《空气动力学学报》 -相关词条
学术公开核心优秀成果效益
空气动力学学报_《空气动力学学报》 -参考资料
[1]2001年全年总目次[J];空气动力学学报;2001年04期;116-120
[2]邓学蓥;2002年度中国空气动力学研究进展报告(2003年1月)[J];空气动力学学报;2003年04期;107-111
[3]The2002annualreportofresearchanddevelopmentofaerodynamicsinChina(January2003)[J];空气动力学学报;2003年04期;112-118
[4]张涵信;2020年中国空气动力学发展研究[A];2020年中国科学和技术发展研究(下)[C];2004年
61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1