一 : 《氧化还原反应》PPT课件
氧化还原反应
第1讲 氧化还原反应 概念
一、氧化还原反应的基本概念
1、氧化还原反应的概念: 在反应中有元素化合价变化的化学反应
(1)实质:有电子的转移(得失或偏移)
(2)特征:有元素化合价升降
这是概念判断的根本 依据
【例1】
下列反应中不属于氧化还原反应的是(
C
)
A 、Cl2+H2O==HCl+HClO
B、3CO+Fe2O3==2Fe+3CO2
C、CaCO3+SiO2==CaSiO3+CO2↑
D、3CuS+8HNO3==3Cu(NO3)2+2NO↑+3S↓+4H2O
练习1:判断下列那些为氧化还原反应,并说出理由
①IBr + H2O = HBr + HIO;
②KOH+Cl2=KCl +KClO+H2O ;
③NaH+H2O =NaOH+H2 ;
④CaO2+H2O =Ca(OH)2 +H2O2 ;
⑤5C2H5OH +2KMnO4+3H2SO4 →5CH3CHO
+K2SO4+2MnSO4 +8H2O 。
相关概念的辨析
氧化反应: 物质所含元素化合价升高的过程 还原反应: 物质所含元素化合价降低的过程 氧 化 性: 物质(元素、离子)具有得到电子的性质或能力 还 原 性: 物质(元素、离子)具有失去电子的性质或能力
氧 化 剂: 所含元素化合价降低的反应物 还 原 剂: 所含元素化合价升高的物质 氧化产物: 还原剂失去电子被氧化后的产物 还原产物: 氧化剂得到电子被还原后的产物
2、相关概念:
升、失、还;
降、得、氧; 若说应,正相反。
得电子
化合价降低
发生还原反应
具有氧化性
氧化剂
+
还原剂
还原产物 + 氧化产物 (新还原剂) (新氧化剂)
失电子
化合价升高
发生氧化反应
具有还 原性
相互联系:
化 合 氧 具有 氧 价 化 化 表现 降 性 剂 低 性质 反应物
(同时存在)
得 到 电 子 实质
被 还 原
还 还 原 生成 原 反 产 应 物 反应 产物
还 原 具有 性
特征
(总数相等) (同时生成) (同时进行同时消失)
过程
性质
化 合 还 具有 还 价 原 原 表现 升 性 剂 高
失 去 电 子
被 氧 化
氧 氧 氧 化 化 生成 化 具有 性 反 产 应 物
升、失、还;降、得、氧;若说应,正相反。
2、四大基本反应类型与氧化还原反应间的关系
⑴所有的置换反应都是 分解反应 氧化还原反应 化合反应 ⑵所有的复分解反应都 氧化还原反应 是非氧化还原反应
置换反应
⑶有单质参加的化合反 应一定是氧化还原反应 ⑷有单质生成的分解反 应一定是氧化还原反应
复分解反应
【例2】在 CaH2+2H2O=Ca(OH)2+2H2↑ 的反应中,下列叙述正确的是 C (1)H2是氧化产物 (2)H2是还原产物 (3)H2O是氧化剂 (4)CaH2中氢元素,既被氧化又被还原; (5)氧化产物和还原产物质量比为1:1 A、①②④ B、③④⑤ C、①②③⑤ D、④
10
【例3】在11P+15CuSO4+24H2O= 5Cu3P+6H3PO4+15H2SO4 的反应中,P元素发生的变化是(
C
)
A. 被氧化. B. 被还原
C. 既被氧化又被还原
D.既未被氧化又未被还
原
11
【例4】
(06广东)下列反应中,氧化剂与还原剂物质的 量的关系为1:2的是 A D A. O3+2KI+H2O=2KOH+I2+O2 B. 2CH3COOH+Ca(ClO)2=2HClO+Ca(CH3COO)2 C. I2+2NaClO3=2NaIO3+Cl2 D. 4HCl+MnO2=MnCl2+Cl2↑+H2O
? 1.常见的氧化剂
? (1) 非金属单质:如 Cl2
NaClO等。 ? (2) ? 含 有 高 价 态
、 O2
元
、Br2 、HClO 及
素 的 化 合
物: 浓H2SO4 HNO3、 KMnO4 MnO2 、 、 、
KClO3 、K Cr O NaClO 等。 2 2 、 HClO 、 7
? (3) 某 些 金 属 性 较 弱 的 金 属 的 高 价 态 离
子: Fe3+ 、 Ag+ 、
Pb4+ 、 Cu2+ 等。
? (4)过氧化物: Na2O2 、 H2O2
等。
? 2.常见的还原剂 ? ? ? ? ? (1)活泼金属: K、Na、Mg、Al (2)非金属离子及低价态化合物:
S2-、H2S、I-、SO2、H2SO3、Na2SO3 等。
等。
(3)低价阳离子: Fe2+、Cu+ (4)非金属单质及其氢化物:
H2、C、CO、NH3
等。
? 小结: ? 强氧化剂与强还原性相遇时,一般都会发生氧化 还原反应。 如:H2SO4(浓)与金属、H2S、S2-、HI、I-、 HBr、Br-、Fe2+、P等。 Cl2与金属、H2S、S2-、HI、I-、HBr、Br-、 Fe2+、H2、SO2H2SO3等。 HNO3与金属、H2S、S2-、HI、I-、HBr、Br-、
Fe2+、P、SO2、H2SO3等。
3、氧化还原反应中电子转移的表示方法: ⑴双线桥法—— “谁变谁”
失ne-
氧化剂中得电子元素 + 还原剂中失电子元素=还原产物 + 氧化产物
得ne-
注意:(1) 箭头必须由反应物指向生成物,且两端 对准同种元素。 (2) 箭头方向不代表电子转移方向,仅表示电子转 移前后的变化。
(3) 在“桥”上标明电子的“得”与“失”,且得失电子 总数相等。
4.电子转移及氧化还原关系的表示方法 ---单线桥和双线桥
⑴用双线桥表示电子转移的结果和氧化还原反应的各种关系
失去 2×e-,化合价升高,被氧化
+2 –1 0 +3 -1
+4
化合价升高,被氧化,失 2×e-
2FeCl2 + Cl2 == 2FeCl3
得到 2×e-,化合价降低,被还原
MnO2 + 4HCl(浓) === MnCl2 + Cl2↑ + 2H2O
化合价降低,被还原,得 2e-
-1
+2
0
重点:(1)双箭号(从反应物指向生成物) (2)箭号起、止所指为同一种元素 (3)标出得与失电子及总数(氧化剂得电子总数等于还原 剂失电子总数)
【例5】 用双线桥法表示下列反应的电子转 移方向和数目,并指出氧化剂、还原剂、氧 化产物、还原产物。
1)3Cu+8HNO3(稀)=== 3Cu(NO3)2+2NO↑+4H2O
参考答案:
失去3 × 2e?
?
3Cu+8HNO3(稀) === 3Cu(NO3)2+2NO↑+4H2O
得到2× 3e-
18
2)氯酸钾与二氧化锰混合加热
化合价升高,失去6×2e△
2KClO3====2KCl + 3O2↑ MnO
2
+5 -2
-1
0
化合价降低,得到2×6e氧化剂 还原产物 氧化产物 还原剂
19
3)硫与KOH溶液反应
化合价升高,失去4e0 -2 +4
3S + 6KOH == 2K2S +K2S
O3+3H2O
化合价降低,得到2×2e还原剂 还原产物 氧化剂
氧化产物
20
⑵用单线桥表示电子转移情况
表示氧化剂和还原剂之间元素的电子转移情况时, 将氧化剂中降价元素与还原剂中升价元素用直线连接起 来,箭头从还原剂指向氧化剂,线上标出电子转移总数, 称为“单线桥法”
2e+4 -1
MnO2 + 4HCl(浓) === MnCl2 + Cl2↑ + 2H2O
重点:(1)单箭号(在反应物之间)
加热 +2
0
(2)箭号起点为失电子元素,终点为得电子元素(从还原剂 指向氧化剂)
(3)只标转移电子总数,不标得与失。
有关氧化还原反应的下列叙述正确的是 【例6】
( ) A
A、氧化剂发生还原反应,还原剂发生氧化反应 B、凡有单质参加或生成的反应均为氧化还原反应 C、一个氧化还原反应中,氧化剂和还原剂一定是两种 不同的物质 D、H2与Cl2发生化学反应时,氢元素失去电子,化合 价升高被氧化
第2讲 氧化性还原性 强弱判断
知识点4:氧化性和还原性强弱的判断
氧化性、还原性强弱的判断,是高考考查的重点。根据 不同条件判断的依据是不一样的。其中比较重要的有: ⑴根据氧化还原反应进行判断---强弱律 ⑵根据金属活动顺序表和周期律判断
⑶根据反应条件或反应剧烈程度判断
⑷根据不同还原剂(或氧化剂)与同一种氧化剂(或还 原剂)反应,产物的价态来判断
⑸根据电化学知识进行判断
氧化性、还原性强弱比较规律:
(一)根据方程式判断氧化还原性强弱
?
对于任何氧化还原反应,都满足下列规律:
失电子、化合价升高、被氧化,发生氧化反应
氧化剂 + 还原剂
=
氧化剂的还原产物 + 还原剂的氧化产物
A
B
b
a
得电子、化合价降低、被还原,发生还原反应
氧化性:A >a(氧化产物)
还原性:B > b(还原产物)
重要题型:
例1.根据下列三个方程式: D I2+SO2+2H2O=H2SO4+2HI;2FeCl2+Cl2=2FeCl3; 2FeCl3+2HI=2FeCl2+2HCl+I2有关物质的还原性强弱顺 序是 A I->Fe2+>Cl->SO2 B Cl->Fe2+>SO2> IC Fe2+>I->SO2 D SO2>I->Fe2+>Cl例2. 已知I-、Fe2+、和H2O2均有还原性,它们在酸性 溶液中还原性强弱顺序为: H2O2 < Fe2+ < I- < SO2。 则下列反应不能发生的是( B ) A 2Fe3++SO2+2H2O=2Fe2+ +SO42-+4H+ B H2O2 +H2SO4=SO2+O2+2H2O C I2+SO2+2H2O=H2SO4+2HI D 2Fe3++2I-=2Fe2++I2
(二)根据金属和非金属活动顺序表判断 (1)根据金属活动顺序表
失电子能力逐渐增强,还原性逐渐增强
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
其阳离子得电子能力逐渐增强,氧化性逐渐增强
(2)根据非金属活动顺序判断
F2
Cl2
Br2
I2
S
氧化性逐渐减弱
F-
Cl-
Br-
I-
S2-
还原性逐渐增强
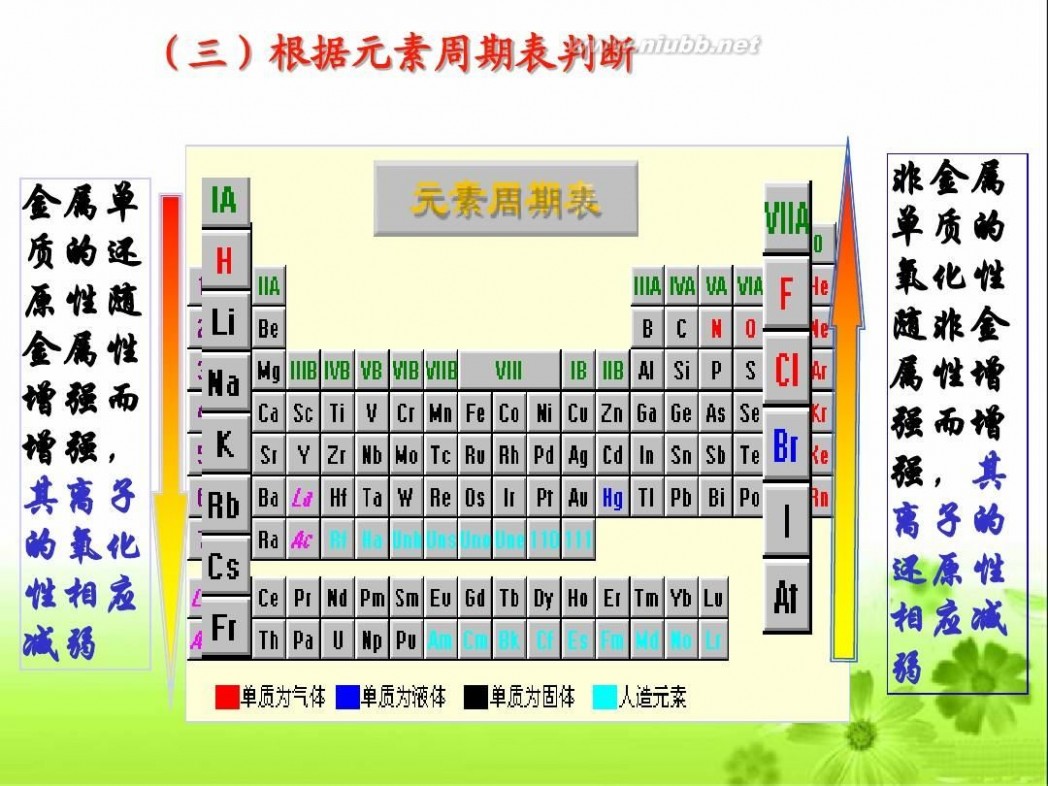
(三)根据元素周期表判断 非金属 单质的 氧化性 随非金 属性增 强
而增 强,其 离子的 还原性 相应减 弱
金属单 质的还 原性随 金属性 增强而 增强, 其离子 的氧化 性相应 减弱
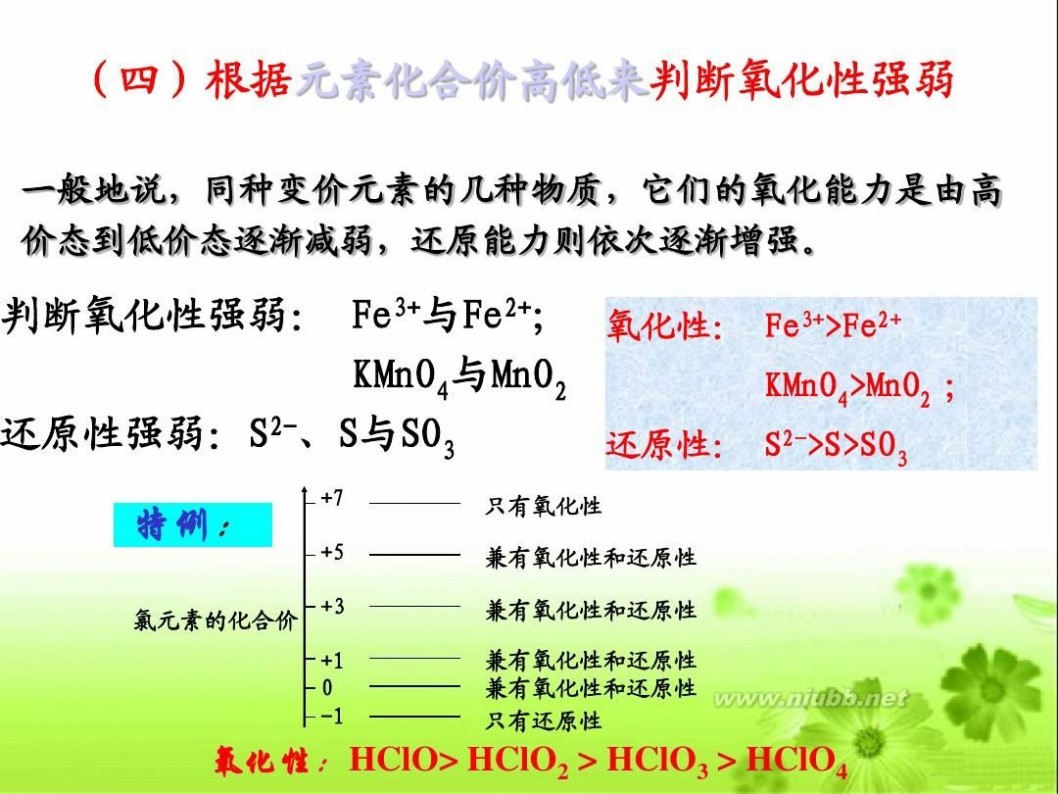
(四)根据元素化合价高低来判断氧化性强弱
一般地说,同种变价元素的几种物质,它们的氧化能力是由高 价态到低价态逐渐减弱,还原能力则依次逐渐增强。
判断氧化性强弱: Fe3+与Fe2+; 氧化性: Fe3+>Fe2+ KMnO4与MnO2 KMnO4>MnO2 ; 还原性强弱:S2-、S与SO3 还原性: S2->S>SO3 特例:
氯元素的化合价
+7 +5 只有氧化性 兼有氧化性和还原性
+3
+1 0 -1
兼有氧化性和还原性
兼有氧化性和还原性 兼有氧化性和还原性 只有还原性
氧化性:HClO> HClO2 > HClO3 > HClO4
(五)根据与同一种物质反应的情况判断氧化性强弱
如:2Fe+3Cl2 = 2FeCl3 Fe+2HCl = FeCl2+H2↑ Cl2能将Fe氧化至+3价,而HCl只能将Fe氧化为+2价,故氧化能力 Cl2>HCl。 又如: MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O 2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O 同是将浓盐酸氧化为Cl2 ,MnO2 必须在加热条件下才能进行,而 KMnO4在常温下即可进行,说明氧化能力KMnO4>MnO2。
(六)外界条件对某些物质氧化性或还原性强弱的影 响
(1)物质的浓度越高,氧化性或还原性越强。
浓HNO3的氧化性强于稀HNO3;H2SO4(浓) > H2SO4(稀)
(2)温度越高,氧化性或还原性越强。
C、CO、H2常温下不显还原性;
(3)酸性越强,氧化性越强;碱性越强,还原性越强。
再如KMnO4氧化性:酸性 > 中性 > 碱性
例题: 1.判断下列反应能否发生?若能发生写出离子反
应方程式,并比较氧化性强弱。
☆ KI溶液滴入FeCl3溶液中 ☆ 2Fe3+ + 2I- = 2Fe2+ + I2
☆ Br2水滴入FeSO4溶液中 ☆ 2Fe2++ Br2 = 2Fe3+ + 2Br☆ KMnO4溶液和FeSO4溶液混合 ☆ MnO4-+ 5Fe2++ 8H+ = 5Fe3+ + Mn2+ + 4H2O 氧化性:Br2 > Fe3+; MnO4- > Fe3+ > I2
氧化性: MnO4-> MnO2 > Cl2 > Br2 > Fe3+ > I2
第4讲
氧化还原反应方程式的 配平
一、氧化还原反应方程式配平的原则和 步骤
1、配平的原则 ①电子转移守恒; ②离子电荷守恒; ③原子个数守恒。
35
一、氧化还原反应方程式配平的原则和 步骤
2、配平的步骤:
“一划、二标、三定、四配、五查”,即划好价,标变 化,定总数,配系数、再检查。 ①确定氧化剂、氧化产物、还原剂、还原产物的化合价 ②用观察法找出元素化合价的变化值 ③用化合价升降总数相等的原则确定化合价变化的物质 的计量数。 ④调整计量数,用观察法确定化合价未变化的物质的计 量数,同时将单线改成等号。 ⑤检查核实各元素原子个数在反应前后是否相等。对于 用离子方程式表示的氧化还原方程式还必须核对反应前后 离子的总电荷数是否相等。
【例1】配平下列方程式
①S十HNO3 — H2SO4+NO
2+H2O ②H2C2O4+ KMnO4+ H2SO4— CO2+ K2SO4+ MnSO4+ H2O
【练习1】配平下列方程式
① KMnO4 + K2S + H2SO4 —— MnSO4 + K2SO4 +H2O
② K2S + HNO3 —— KNO3 + S + NO + H2O
38
二、配平的方法和技巧
1、逆向配平法:
(1)适用对象:部分氧化还原反应;自身 氧化还原反应;歧化反应。 (2)方法:从右边生成物着手配平,即: 选择氧化产物、还原产物为基准物质进 行配平。
二、配平的方法和技巧
1、逆向配平法: 【例2】配平下列氧化还原反应方程式:
3
0
S +
6
KOH
—
2 K2S + K2SO3 + 2 ?2 4 ?1
-2
+4
3 H2O
1 K2Cr2O7
+6
14 + +8 HCl 6
-1
—
+3 0 2 KCl +2 CrCl3 + 7 H2O + Cl2↑ 3
3 ?2
1?2 ?3
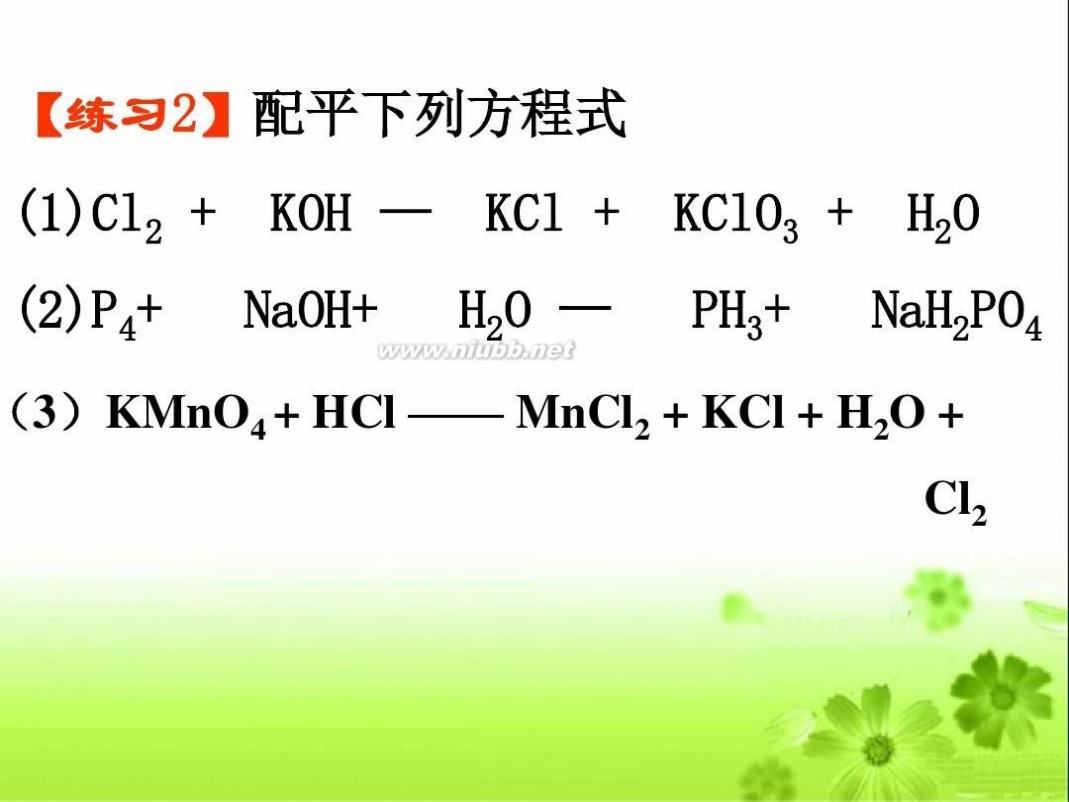
【练习2】配平下列方程式 (1)Cl2 + (2)P4+ KOH — NaOH+ KCl + H2O — KClO3 + PH3+ H2O NaH2PO4
(3)KMnO4 + HCl —— MnCl2 + KCl + H2O +
Cl2
二、配平的方法和技巧
2、零价法: 适宜于还原剂中两种元素价态难以确定但均属 于升高的氧化还原反应。 【例3】 Fe3P+ HNO3—— Fe(NO3)3+ NO+ H3PO4+ H2O
【练习3】配平下列方程式
FeS2 + O2 —— Fe2O3 + SO2
二、配平的方法和技巧
3、缺项配平:
缺项方程式:某些反应物或生成物的分子式未写出(缺 项),它们一般为水、酸、碱。
配平方法:①先配氧化剂、还原剂及还原产物与 氧化产物;
②再根据质量守恒、电荷守恒确定所缺的物质 的化学式(分子或离子); ③最后观察配平其他物质系数。
【例4】配平下列方程式 3 Pt +
0
4 HNO3+
+4
+5
18 HCl —
+2
3 H2PtCl6 + 4 ?3
4 NO↑ + 8 H2O 3 ?4
比较两边H、O原子个数不等,可见生成物 中含有H、O元素,再比较反应物比生成物 多8个O、16个H,故知生成物为H2O,水的 系数为8。
【例5】配平下列方程式 6 Fe2+ + 1?2 ?3 2 Fe(OH)3+
+3 +2
3 ClO- + 3 2 ?3
+1
H2O —
-1
4 Fe3+ +
+3
3 Cl-
①考虑电子得失守恒 ②考虑电荷守恒: ClO- 所带电荷与Cl- 所带电 荷一致; Fe2+所带正电荷为+4,Fe3+所带正电荷 为+3,最小公倍数为12,故Fe2+的系数再乘以3, ③根据Fe元素守恒: Fe(OH)3的系数为2; (O守恒),ClO- 的系数为3。
【练习4】配平下列方程式 2 Cr(OH)4- + 2 3 ?2
+6 -1
+3
OH-
+ 3 ClO-—
+1
2 ?3
2 CrO42- + 3 Cl- + 5 H2O
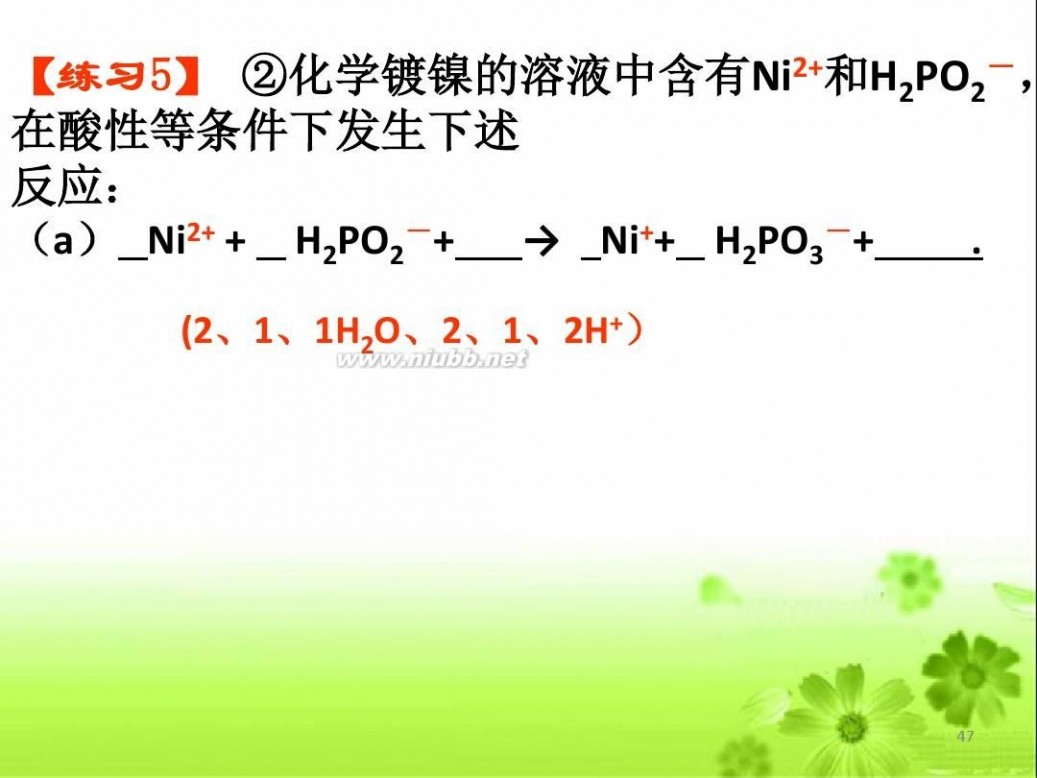
【练习5】 ②化学镀镍的溶液中含有Ni2+和H2PO2-, 在酸性等条件下发生下述 反应:
(a) Ni2+ + H2PO2-+ → Ni++ H2PO3-+ .
(2、1、1H2O、2、1、2H+)
47
【配平练习】
(1)Mn2++S2O82-+H2O—SO42-+MnO4-+□( ) (2)Zn+H++NO3-—Zn2++NH4++□( ) (3) H2O2+Cr2(SO4)3+□——K2SO4+K2CrO4+H2O
(1) (2) 2、5、8、10、2、16H+ 4、10、1、4、1、3H2O
(3)
3、1、10KOH、3、2、、8
48
【练合练习1】
某一反应体系中有反应物和生成物共五种物 质:S、H2S、HNO3、NO、H2O。已知水是反应产 物之一。 (1)
该反应中的还原剂是________,该反应中的 还原产物是__________。
(2)写出该反应的化学方程式并标出电子转移方 向和数目_______________________________。
(3)若反应过程中转移了0.3mol 电子,则生成水的 质量是_______。
【配平练习】
(1)Mn2++S2O82-+H2O—SO42-+MnO4-+□( ) (2)Zn+H++NO3-—Zn2++NH4++□( ) (3) H2O2+Cr2(SO4)3+□——K2SO4+K2CrO4+H2O
(1) (2) (3) 2、5、8、10、2、16H+ 4、10、1、4、1、3H2O 3、1、10KOH、3、2、、8
50
二 : 氧化还原反应PPT

氧化还原反应ppt 氧化还原反应PPT

氧化还原反应ppt 氧化还原反应PPT
氧化还原反应ppt 氧化还原反应PPT

氧化还原反应ppt 氧化还原反应PPT

氧化还原反应ppt 氧化还原反应PPT

氧化还原反应ppt 氧化还原反应PPT

氧化还原反应ppt 氧化还原反应PPT

氧化还原反应ppt 氧化还原反应PPT

氧化还原反应ppt 氧化还原反应PPT

氧化还原反应ppt 氧化还原反应PPT

氧化还原反应ppt 氧化还原反应PPT
氧化还原反应ppt 氧化还原反应PPT
氧化还原反应ppt 氧化还原反应PPT
氧化还原反应ppt 氧化还原反应PPT

氧化还原反应ppt 氧化还原反应PPT

氧化还原反应ppt 氧化还原反应PPT
氧化还原反应ppt 氧化还原反应PPT

氧化还原反应ppt 氧化还原反应PPT

氧化还原反应ppt 氧化还原反应PPT

三 : 《氧化还原反应》PPT课件
氧化还原反应ppt 《氧化还原反应》PPT课件
氧化还原反应ppt 《氧化还原反应》PPT课件
氧化还原反应ppt 《氧化还原反应》PPT课件

氧化还原反应ppt 《氧化还原反应》PPT课件

氧化还原反应ppt 《氧化还原反应》PPT课件

氧化还原反应ppt 《氧化还原反应》PPT课件

氧化还原反应ppt 《氧化还原反应》PPT课件

氧化还原反应ppt 《氧化还原反应》PPT课件

氧化还原反应ppt 《氧化还原反应》PPT课件

氧化还原反应ppt 《氧化还原反应》PPT课件

氧化还原反应ppt 《氧化还原反应》PPT课件

氧化还原反应ppt 《氧化还原反应》PPT课件

氧化还原反应ppt 《氧化还原反应》PPT课件
氧化还原反应ppt 《氧化还原反应》PPT课件

氧化还原反应ppt 《氧化还原反应》PPT课件

氧化还原反应ppt 《氧化还原反应》PPT课件

氧化还原反应ppt 《氧化还原反应》PPT课件

氧化还原反应ppt 《氧化还原反应》PPT课件

氧化还原反应ppt 《氧化还原反应》PPT课件
氧化还原反应ppt 《氧化还原反应》PPT课件

氧化还原反应ppt 《氧化还原反应》PPT课件

氧化还原反应ppt 《氧化还原反应》PPT课件

四 : 氧化还原反应PPT
氧化还原反应
思考交流
物质燃烧 食物腐败 冶炼金属 金属电镀 新陈代谢
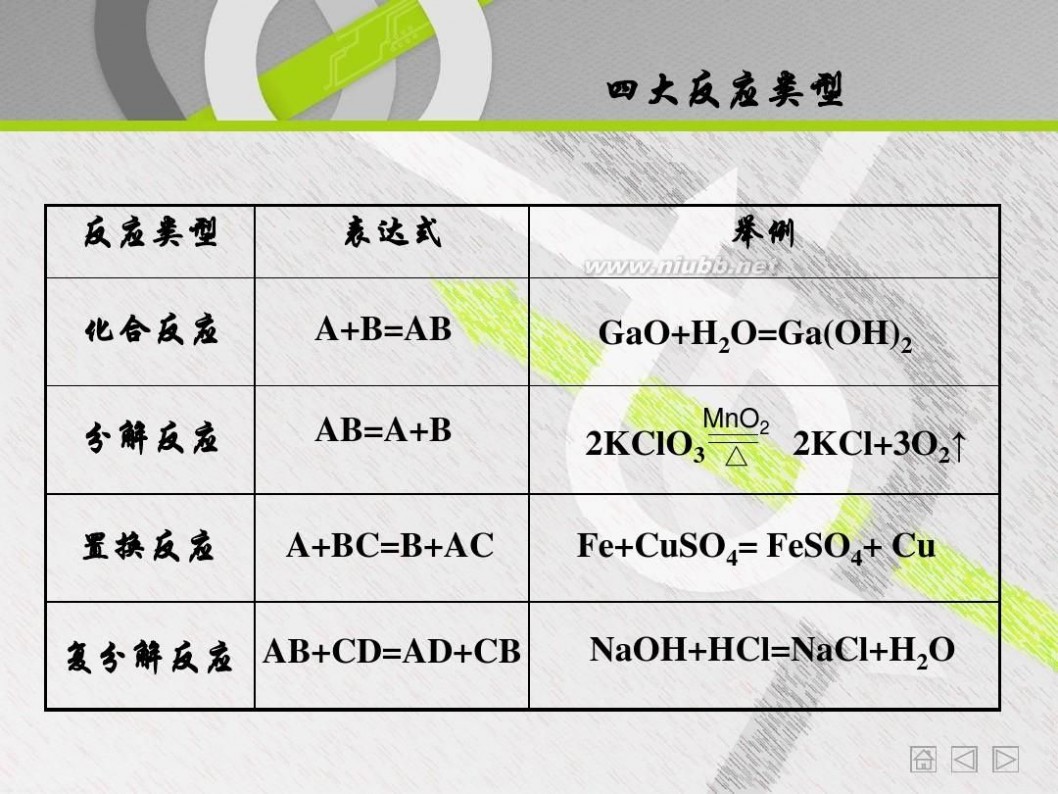
四大反应类型
反应类型 化合反应
表达式 A+B=AB AB=A+B
举例 GaO+H2O=Ga(OH)2
MnO2 2KClO3 △
分解反应
置换反应
2KCl+3O2↑
A+BC=B+AC
Fe+CuSO4= FeSO4+ Cu
NaOH+HCl=NaCl+H2O
复分解反应 AB+CD=AD+CB
分析下面反应的反应类型
Fe2O3+3CO=2Fe+3CO2
氧化还原反应 在初中我们也学过氧化反应和还原反应, 请同学们举出两例:
2Mg+O2=2MgO CuO+H2=H2O+Cu
氧化还原反应 一.得失氧的角度 氧化反应:物质得到氧的反应 还原反应:物质失去氧的反应
CuO + H2 = H2O + Cu
CuO H2 Cu H2O 失去氧 还原反应 得到氧 氧化反应
一种物质失去氧必有一种物质得到氧,在 同一个反应中既有还原反应又有氧化反应
氧化还原反应
如何定义氧化还原反应?
既有物质得到氧 又有物质失去氧
还原反应和氧化反应是一个反应中同时发生的 两个过程
氧化还原反应 假如一个反应中没有得失氧的情况发生是不是 氧化还原反应呢?如 :
Fe+CuSO4=FeSO4+Cu
氧化还原反应
标出化合价
+2 0 +1 0
CuO + H2 = H2O + Cu
+2 0
CuO
0
Cu
+1
失去氧 得到氧
还原反应 氧化反应
化合价降低 化合价升高
H2
H2O
从这个例子中同学们可以得到什么结论?
氧化还原反应 二.化合价升降的角度
氧化反应:物质所含元素化合价升高的反应 还原反应:物质所含元素化合价降低的反应
Fe+CuSO4=FeSO4+Cu
同一种元素在反应前后有化合价的变化,在这 个反应中有化合价的升高,必有化合价的降低
氧化还原反应 定义:凡是有元素化合价升降的化学 反应都是氧化还原反应。
2Na+Cl2 =2NaCl
√
√
H2+Cl2 =2HCl
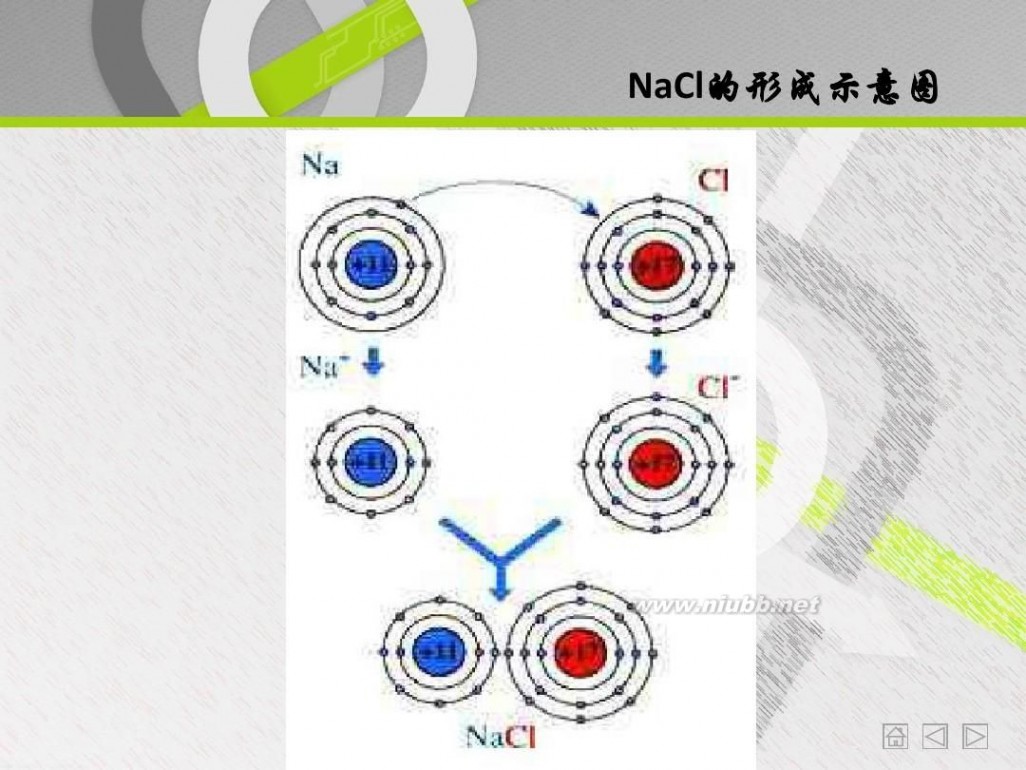
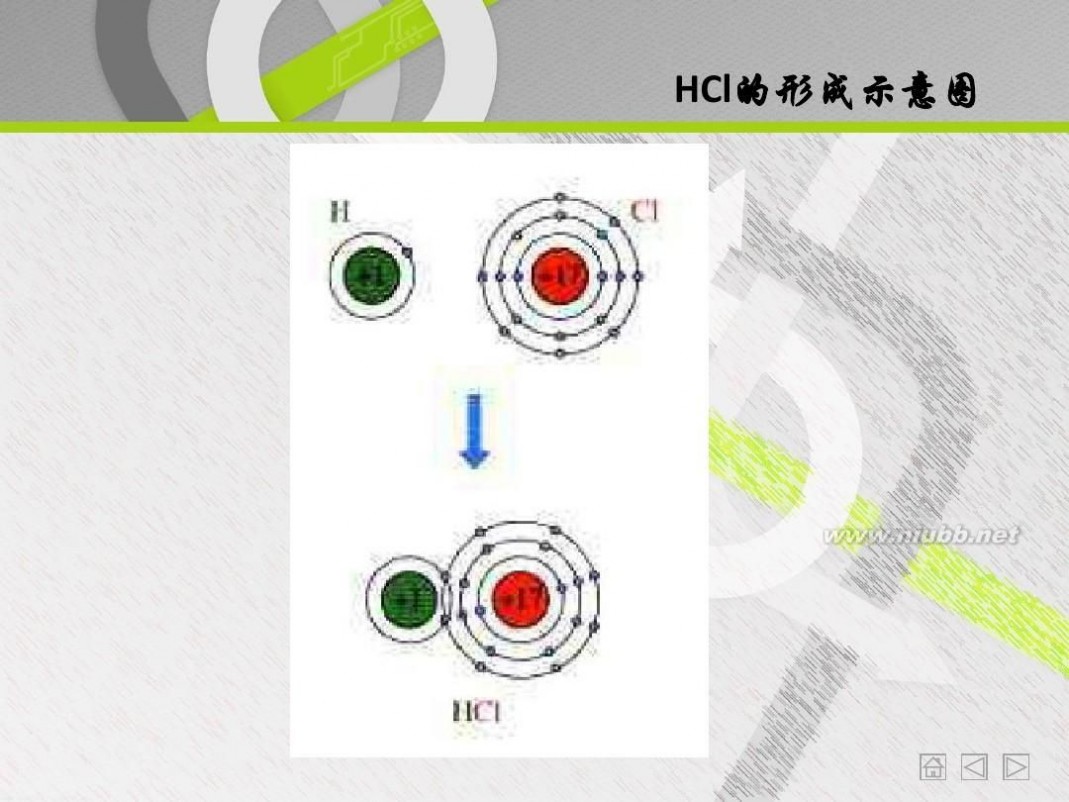
化合价的升降是什么原因引起的? 如何在上述两反应中表达出来?
NaCl的形成示意图
HCl的形成示意图
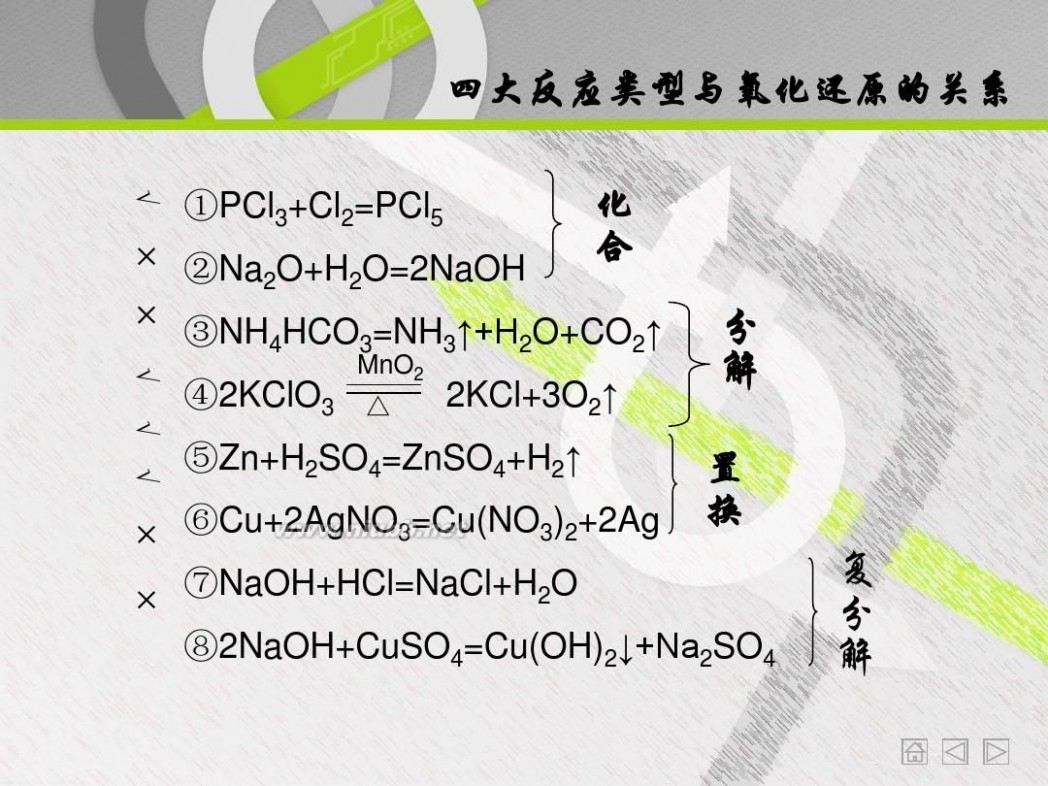
四大反应类型与氧化还原的关系
①PCl3+Cl2=PCl5 ②Na2O+H2O=2NaOH ④2KClO3
MnO2 △
化 合 分 解 置 换 复 分 解
√ × × √ √ √ × ×
③NH4HCO3=NH3↑+H2O+CO2↑ 2KCl+3O2↑ ⑤Zn+H2SO4=ZnSO4+H2↑ ⑥Cu+2AgNO3=Cu(NO3)2+2Ag ⑦NaOH+HCl=NaCl+H2O
⑧2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
四大反应类型与氧化还原的关系
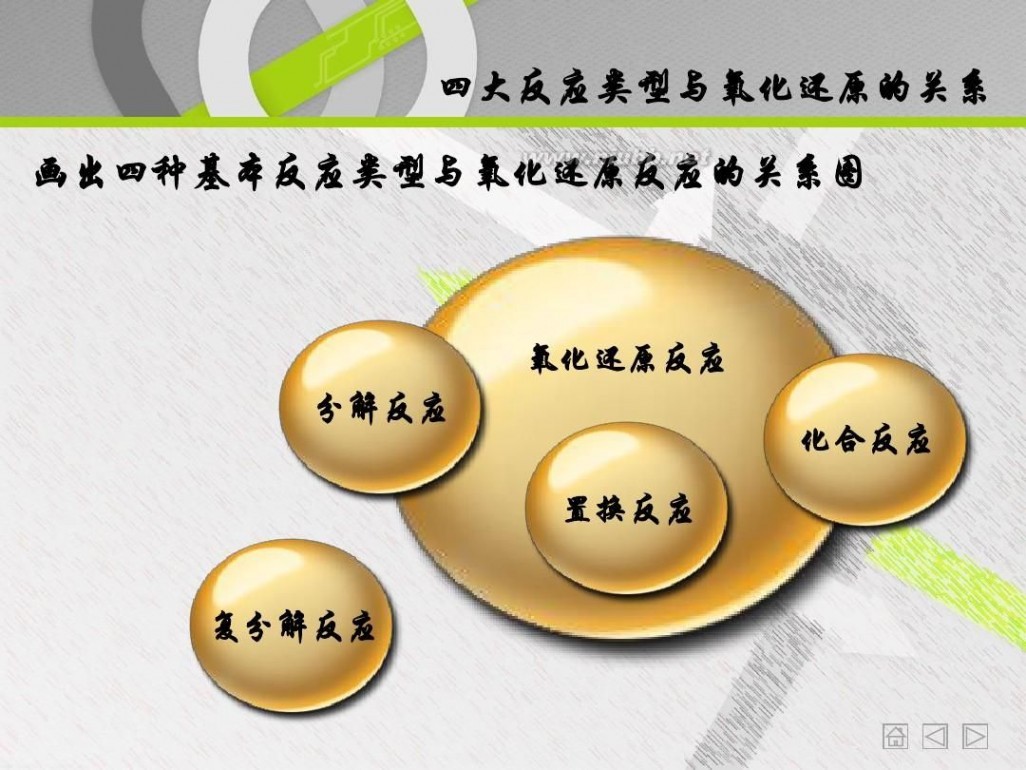
从上面几组练习可以看出四种基本反应类型 与氧化还原反应有什么关系? 置换反应都属于氧化还原反应
复分解反应都是非氧化还原反应 分解和化合反应可能是氧化还原反应
四大反应类型与氧化还原的关系
①PCl3+Cl2=PCl5
MnO2 ④2KClO3 △ 2KCl+3O2↑
观察①④能得出什么结论? 单质参加的化合反应是氧化还原反应 单质生成的分解反应是氧化还原反应
四大反应类型与氧化还原的关系
画出四种基本反应类型与氧化还原反应的关系图
氧化还原反应 分解反应 置换反应 复分解反应 化合反应
习 题
化学反应中
,属于氧化还原反应的是( )
A.Na2CO3+CaCl2=CaCO3↓+2NaCl
B.Fe+CuSO4=Cu+FeSO4
C.2NaHCO3=Na2CO3+CO2↑+H2O
D.CaO+H2O=Ca(OH)2
△
习 题
下列有关四种基本反应类型与氧化原反 应关系的说法中正确的是( ) A.化合反应一定是氧化还原反应 B.分解反应一定不是氧化还原反应 C.置换反应一定是氧化还原反应 D.复分解反应不一定是氧化还原反应
谢谢观赏
霍春宝
Made Chunbao Huo
61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1