一 : 小煜同学通过学习知道,乙醇汽油是一种新型车用燃料,于是他对汽油中添加乙醇的目的进行了如下探究.
小煜同学通过学习知道,乙醇汽油是一种新型车用燃料,于是他对汽油中添加乙醇的目的进行了如下探究.
【猜想】猜想1:可以减少汽车尾气的污染;
猜想2:可以产生更多的热量,增强汽车的动力.
【设计与实验】
| 序号 | 实验步骤 | 实验现象 | 结论 |
| Ⅰ | 在两个蒸发皿中各加入10 mL冷水,控制相同燃烧条件,分别用乙醇和汽油作为燃料进行加热,记录从开始加热到水沸腾的时间 | 用乙醇加热耗时118s;用汽油加热耗时56s | 猜想2______ (填“成立”或“不成立”) |
| Ⅱ | 实验Ⅰ停止加热后,取下蒸发皿,观察蒸发皿的底部 | 用乙醇加热的蒸发皿底部只有极少量炭黑,而用汽油加热的蒸发皿底部有大量炭黑 | 猜想1成立(可依照上格填写) |
(1)实验Ⅰ是一个对比实验,实验过程中不一定要控制的条件是______(填序号).
A.水的初始温度必须相同
B.加热开始计时点必须相同
C.燃具产生火焰的大小必须相同
D.蒸发皿的大小必须相同
(2)汽车的发动机、排气管等部件易出现积炭,使用乙醇汽油后,这些部件产生的积炭量将______.
(3)目前乙醇汽油中乙醇的添加量约为10%,可一定程度节省石油资源.结合实验Ⅰ的结论分析,如果乙醇的添加量过大,会使汽车动力______(填“增强”“减弱”或“不变”).
【设计与实验】
Ⅰ、加热相同量的水,用乙醇耗时多,用汽油耗时少,说明汽油的热值比乙醇高.
故填:不成立.
【分析与讨论】
(1)加热开始计时点可以相同,也可以不同,因为开始计时点相同或不同,都不影响实验结论.
故填:B.
(2)乙醇比汽油清洁,燃烧时生成的固体颗粒物少,所以使用乙醇汽油后,这些部件产生的积炭量将减少.
故填:减少.
(3)使用乙醇汽油,可在一定程度上节省石油资源,但是结合实验Ⅰ的结论分析,如果乙醇的添加量过大,会使汽车动力减弱.
故填:减弱.
答案:
【设计与实验】
Ⅰ不成立;
【分析与讨论】
(1)B;
(2)减少;
(3)减弱
二 : 他通过几个月学会了移动营销 只因知道这3点
中国经济已步入新常态,将覆盖中国产业经济模式,企业面对新的经济环境挑战,将不断寻求新营销方案的转变。流量红利给移动营销带了巨大的发展潜能,app流量激增、移动互联网生活带来丰富的用户数据。

盘点移动营销的3大特点:
1.移动渠道成为数字营销新焦点。智能终端成为数字营销的主战场,移动端流量激增,优质APP资源增多,移动端的营销增速极快,视频广告,原生广告快速增长,未来移动端广告支出将成为移动营销市场发展新的增长点。
2.海量数据应用使用移动营销更精准,移动端数据应用不仅在量级上取得突破,更在数据背后的用户感知上更加精准,利用数据技术对受众的静态属性,动态属性、消费习惯等进行分析,使得更加精准的营销成为可能。
3.全功能打通早就场景营销可能,生活类应用在移动系统端落地,受众的出行,购物。吃喝、社交、支付等行为均可在移动端进行,全生态全功能打通也成为移动营销提供了更多有效注意力,用户数据和价值场景,造就其优势。
因此,企业要及时布局在移动端。那么如何实施移动营销才能取得满意的效果了?
1.要“fun”营销,用有趣的营销方式来吸引用户的眼球。过去缺乏趣味性的线下活动,缺乏用户之间的互动性,正如为微三云多达20多项的营销模块,广告的N次传播会引起病毒式扩散摇一摇,拼团,微砍价等等。
用户作为分享最大的主体,所带来的信任和人格背书,为基于真实场景的社交带来信任溢价。
2.建立自己的移动app。A PP营销成为移动营销主要形式,移动APP贡献了移动端大多数的流量,也带了巨大的广告需求,聚合的移动应用广告。
自己组建团队开发,消耗时间,人力成本、见效慢。倒不如选择微三云移动社交APP,助力企业实现自身的多屏互动战略以及收入模式的多元化。
微三云移动社交APP优势主要体现在3大方面:
1)信息触达和用户体验:广告更像是用户真正所需要的信息;
2)消费者洞察:移动端用户黏性强,场景丰富,可得到更全面的用户画像。
3)数据价值变现:数据挖掘和定向优化,各大平台流量汇总集中,数据沉淀到移动社交分销APP, 后台实时监控和定期数据分析,找到核心问题与用户,实现目标用户精准营销, 帮助企业实现业绩联动的量化管理,加强企业内部的战略导向,优化管理。
在移动快速取代传统产业时代,企业只有站在这个趋势的前沿,同时抓住用户心里和时代动向,才有可能不被淘汰。
更多资讯尽在www.weisanyun.com
三 : 小煜同学通过学习知道,乙醇汽油是一种新型车用燃料,于是他对汽油中添加乙醇的目的进行了如下研究.【猜想

| 小煜同学通过学习知道,乙醇汽油是一种新型车用燃料,于是他对汽油中添加乙醇的目的进行了如下研究. 【猜想】猜想1:可以减少汽车尾气的污染; 猜想2:可以产生更多的热量,增强汽车的动力. 【设计与实验】
(1)实验Ⅰ是一个对比实验,实验过程中不一定要控制的条件是______(填序号); A.水的始温度必须相同 B.加热开始计时点必须相同 C.燃具产生火焰的大小必须相同 D.蒸发皿的大小必须相同 (2)汽车的发动机、排气管等部件易出现积碳,使用乙醇汽油后,这些部件产生的积炭量将______; (3)目前乙醇汽油中乙醇的添加量约为10%,可一定程度节省石油资源.结合实验Ⅰ的结论分析,如果乙醇的添加量过大,会使汽车动力______(填“增强”、“减弱”或“不变”) |
| 【设计与实验】 Ⅰ、加热相同量的水,用乙醇耗时多,用汽油耗时少,说明汽油的热值比乙醇高. 故填:不成立. Ⅱ、用乙醇加热的蒸发皿底部只有极少量炭黑,而用汽油加热的蒸发皿底部有大量炭黑,说明汽油燃烧生成的污染物比乙醇燃烧生成的污染物多,所以汽油中添加乙醇可以减少汽车尾气的污染; 猜想1成立. 故填:猜想1成立. 【分析与讨论】 (1)加热开始计时点可以相同,也可以不同,因为开始计时点相同或不同,都不影响实验结论. 故填:B. (2)乙醇比汽油清洁,燃烧时生成的固体颗粒物少,所以使用乙醇汽油后,这些部件产生的积炭量将减少. 故填:减少. (3)使用乙醇汽油,可在一定程度上节省石油资源,但是结合实验Ⅰ的结论分析,如果乙醇的添加量过大,会使汽车动力减弱. 故填:减弱. |
考点:
考点名称:乙醇定义: 2CO2+3H2O
2CO2+3H2O  2CO2+2CO+6H2O安全措施:
2CO2+2CO+6H2O安全措施:
四 : 小煜同学通过学习知道,乙醇汽油是一种新型车用燃料,于是他对汽油中添加乙醇的目的进行了如下探究。【猜想
| 小煜同学通过学习知道,乙醇汽油是一种新型车用燃料,于是他对汽油中添加乙醇的目的进行了如下探究。 【猜想】猜想l:可以减少汽车尾气的污染; 猜想2:可以产生更多的热量,增强汽车的动力。 【诒计与实验】
【分析与讨论】 (1)实验I是一个对比实验,实验过程中不一定要控制的条件是(填序号); A.水的初始温度必须相同B.加热开始计时点必须相同 C.燃具产生火焰的大小必须相同 D.蒸发皿的大小必须相同 (2)汽车的发动机、排气管等部件易出现积炭,使用乙醇汽油后,这些部件产生的积炭量将; (3)目前乙醇汽油中乙醇的添加量约为10%.可一定程度节省石油资源。结合实验I的结论分析,如果乙醇的添加量过大,会使汽车动力(填“增强"、“减弱"或“不变")。 |
【设计与实验】
【分析与讨论】 (1)B (2分) (2)减少 (1分) (3)减弱 (2分) |
| 根据实验现象分析,相同条件下,分别用汽油和用乙醇加热相同质量的水,乙醇所用时间长,说明乙醇燃烧产生的热量比汽油少,即猜想2不成立;蒸发皿背面炭黑多少说明燃料充分燃烧还是不充分燃烧,用汽油加热的蒸发皿背面有大量炭黑,说明汽油比乙醇更易发生不完全燃烧,易产生一氧化碳等大气污染物,所以从环保角度分析,汽油比乙醇对环境的影响更大,也说明了用乙醇汽油代替汽油更环保;实验中用测量加热等质量的水所所需的时间判断汽油和乙醇燃烧产生热量的多少,为此需要控制相关的变量,变量一是水的超始温度,变量二是加热仪器产生火焰的大小,变量三是蒸发皿的大小(涉及蒸发皿与火焰的接触面积),由于测定的时间是从开始加热到沸腾所需的时间,所以开始计时的时间无关;由于乙醇汽油较汽油更容易充分燃烧,所以用乙醇汽油的汽车更不易发生积炭现象;但由于乙醇的热值较汽油低,添加乙酬后,汽车的动力将会减弱。 |
考点:
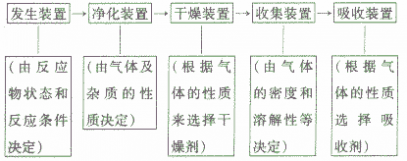
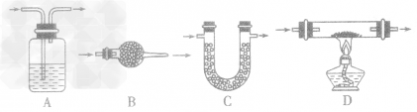
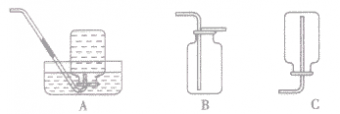
考点名称:实验室制取和收集气体的思路实验室制取气体的思路: ”的反应,简称“固体加热型”,装置如图A所示,如用KMnO4或KClO3和MnO2制O2。
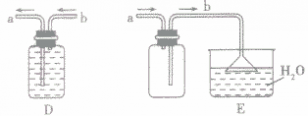
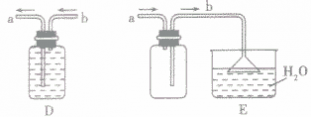
”的反应,简称“固体加热型”,装置如图A所示,如用KMnO4或KClO3和MnO2制O2。  ”的反应,简称“固液常温型”,装置如图B、C、D、E。如用H2O2和MnO2制O2、用锌粒与稀H2SO4制H2或用CaCO3与稀盐酸制CO2。同B装置相比,D装置具有便于添加液体药品,制取的气体量较多的优点;C装置不仅添加液体药品方便,而且可通过导管上的开关控制反应的发生和停止;E装置可通过分液漏斗的活塞控制加入药品的量和速度。
”的反应,简称“固液常温型”,装置如图B、C、D、E。如用H2O2和MnO2制O2、用锌粒与稀H2SO4制H2或用CaCO3与稀盐酸制CO2。同B装置相比,D装置具有便于添加液体药品,制取的气体量较多的优点;C装置不仅添加液体药品方便,而且可通过导管上的开关控制反应的发生和停止;E装置可通过分液漏斗的活塞控制加入药品的量和速度。 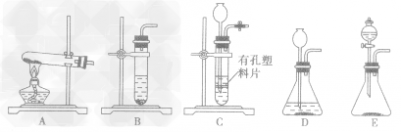
 ”的反应的发生装置的其他改进:
”的反应的发生装置的其他改进:
| 收集装置 |  |  |  |
| 选择条件 | 难溶或微溶于水,与水不发生化学反应的气体。如:H2、 O2、CH4等 | 不与空气发生反应,密度比空气密度大的气体。如:O2、 CO2等 | 不与空气发生反应,密度比空气密度小的气体。如:H2、CH4等 |
| 说明 | ①使用排水法收集的气体较纯净,但缺点是会使收集的气体中禽有水蒸气。当导管口有连续均匀的气泡冒出时才开始收集,当有大量气泡从集气瓶口冒出时,表明气体已收集满。 ②用向上排空气法收集气体,应注意将导管伸到接近集气瓶瓶底,同时应在瓶口盖上玻璃片,以便尽可能地排尽空气,提高所收集气体的纯度。使用排空气法收集的气体比较十燥,但纯度较低,需要验满(可燃性气体则要注意安全,点燃之前一定要验纯,否则有爆炸危险) | ||
| 吸收剂 | 吸收的气体杂质 | 吸收剂 | 吸收的气体杂质 |
| 水 | 可溶性的气体:HCl,NH3 | NaOH | CO2,HCl,H2O |
| 无水CuSO4 | H2O | 碱石灰 | CO2,HCl ,H2O |
| 灼热的铜网 | O2 | NaOH | CO2,HCl |
| 灼热的CuO | H2,CO | 浓硫酸 | H2O |
 Cu+CO2
Cu+CO2| 干燥剂 | 可干燥的气体 | 不可干燥的气体 | ||
| 名称或化学式 | 酸碱性 | 状态 | ||
| 浓H2SO4 | 酸性 | 液体 | H2、N2、O2、CO2、HCl、CH4、CO | NH3 |
| 固体NaOH、生石灰,碱石灰(氢氧化钠和生石灰的混合物) | 碱性 | 固态 | H2、O2、N2、CH4、CO、NH3等 | CO2、SO2、HCl |
| 无水CaCl2 | 中性 | 固态 | 除NH3外的所有气体 | NH3 |
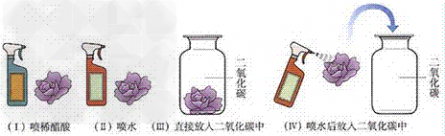
 考点名称:二氧化碳的性质实验探究二氧化碳的三个性质实验:
考点名称:二氧化碳的性质实验探究二氧化碳的三个性质实验: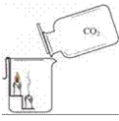


| 序号 | 1 |
| 实验名称 | 点不着的“纸” |
| 家庭用到的实验器材及药品 | 铜棒两张相同的长条白纸火柴 |
| 实验步骤 | 1、用火柴直接点其中的一张纸条; 2、将另一张纸条先以螺旋形紧紧地缠绕在铜棒上,再去点燃; |
| 实验现象 | 1、纸条迅速燃烧 2、纸条没有燃烧 |
| 实验结论 | 因为铜具有良好的导热性,将加热处的热量迅速传导散失,使其温度达不到纸条的着火点而点不着。 |
| 注意事项 | 铜棒是金属,有良好的导热性,注意勿烫手。 |
| 序号 | 2 |
| 实验名称 | “神奇”的手帕 |
| 家庭用到的实验器材及药品 | 酒精的水溶液(1:1)棉手帕钳子(两只)火柴 |
| 实验步骤 | 把棉手帕放入用酒精与水以1:1配成的溶液里浸透,然后轻挤,用两只钳子分别夹住手帕两角,放到火上点燃,等火焰减小时迅速摇动手帕,使火焰熄灭。 |
| 实验现象 | 手帕依旧完好如初。 |
| 实验结论 | 燃烧时,酒精的火焰在水层外,吸附在纤维空隙里的水分吸收燃烧放出的热量而蒸发,手帕上的温度达不到纤维的着火点,因而手帕烧不坏。 |
| 注意事项 | 由于火焰温度较高,注意别烧伤手及对着其他人,且远离其它可燃物。 |
| 序号 | 3 |
| 实验名称 | 金属性质“谁更强” |
| 家庭用到的实验器材及药品 | 白醋、铝片、铁片、铜片、剪刀、砂纸、玻璃杯 |
| 实验步骤 | 1、用三个小玻璃杯各取适量白醋,用砂纸把三种金属打磨光亮,再用剪刀剪三种金属少量分别加入白醋中; 2、用剪过剩下的铝片放入放铁的杯子中,充分振荡; |
| 实验现象 | 1、放铝和铁的杯子中产生气泡,放铜的杯子中没有,且放铁的杯子中溶液颜色变为浅绿色; 2、铝片表面出现灰黑色固体,且溶液颜色由浅绿色变为无色; |
| 实验结论 | 1、铝和铁的活动性都比铜强; 2、铝的活动性大于铁;所以:铝>铁>铜 |
| 注意事项 | 观察颜色的变化要仔细呦! |
| 序号 | 4 |
| 实验名称 | 自制碳酸饮料 |
| 家庭用到的实验器材及药品 | 凉开水250克、柠檬汁1.5克、白糖8克、小苏打(NaHCO3)1.5克、500ml饮料瓶、适量果汁 |
| 实验步骤 | 1、在约500mL的饮料瓶中加入约8克白糖和适量果汁;2、加入约1.5g小苏打;3、注入凉开水;4、再加入约1.5g柠檬汁;5、立即旋紧瓶盖,摇匀,放入冰箱。半小时后,你就可以喝到清凉甘甜的汽水了。 |
| 实验现象 | 1、产生气泡; 2、气泡消失。 |
| 实验结论 | 1、碳酸氢钠与柠檬酸反应,生成二氧化碳; 2、二氧化碳与水反应生成碳酸,即碳酸饮料。 |
| 注意事项 | 原料的量,根据口味不同,适当可以调整呦! |
| 序号 | 5 |
| 实验名称 | “切断”的烛焰 |
| 家庭用到的实验器材及药品 | 粗铜丝(多股)蜡烛火柴 |
| 实验步骤 | 1、用粗铜丝绕成一个内径比蜡烛直径稍小点的线圈,圈与圈之间需有一定的空隙;2、点燃蜡烛,把铜丝制成的线圈放在火焰的中间。 |
| 实验现象 | 铜圈上方的火焰被“切断”,下方的火焰正常燃烧。 |
| 实验结论 | 铜具有良好的导热能力。当铜丝罩在蜡烛火焰的中间时,上方火焰的热量被铜丝带走,使蜡烛火焰上方的温度低于其着火点,上方火焰就熄灭了。 |
| 注意事项 | 小心烫手呦! |
| 序号 | 6 |
| 实验名称 | 瓶“吃”鸡蛋 |
| 家庭用到的实验器材及药品 | 熟鸡蛋白醋广口瓶蘸有酒精的棉球火柴镊子 |
| 实验步骤 | 1、将熟鸡蛋浸在白醋中,待鸡蛋壳变软后,将蛋取出;2、找一个瓶口略比鸡蛋小的广口瓶,往广口瓶中投入一燃着的酒精棉球,迅速将鸡蛋的小头对准瓶口。 |
| 实验现象 | 1、鸡蛋壳表面产生许多气泡; 2、鸡蛋很快被吸入瓶中。 |
| 实验结论 | 酒精燃烧消耗瓶中氧气,瓶中压强低于外界大气压,外界气压把鸡蛋压入瓶中。 |
| 注意事项 | 注意鸡蛋放入瓶口的时机;瓶中的鸡蛋可能会变硬。 |
| 序号 | 7 |
| 实验名称 | 水变“汽水” |
| 家庭用到的实验器材及药品 | 白醋(CH3COOH)碱面(Na2CO3)自来水玻璃棒细玻璃杯 |
| 实验步骤 | 1、取适量碱面溶于水,用玻璃棒搅拌,形成澄清液体;2、倒入白醋。 |
| 实验现象 | 可看到有大量气泡从液体中涌出,犹如“汽水”一般。 |
| 实验结论 | 碳酸钠与醋酸反应生成二氧化碳气体。 |
| 注意事项 | 白醋与碱面的量,可以自己控制呦! |
| 序号 | 8 |
| 实验名称 | 水变“牛奶” |
| 家庭用到的实验器材及药品 | 碱面生石灰自来水玻璃棒细玻璃杯 |
| 实验步骤 | 1、取适量碱面和生石灰,分别溶于水,用玻璃棒搅拌,取上层清液于两细玻璃杯中;2、把一细玻璃杯中的液体倒入另一细玻璃杯中。 |
| 实验现象 | 产生像“牛奶”一样的白色浑浊。 |
| 实验结论 | 1、生石灰与水反应生成氢氧化钙; 2、碳酸钠与氢氧化钙反应生成碳酸钙,碳酸钙难溶于水。 |
| 注意事项 | 因为石灰有腐蚀性,在配制石灰水时,注意安全,防止溅到皮肤、衣服,特别是眼睛。 |
| 序号 | 9 |
| 实验名称 | 硬、软水检验 |
| 家庭用到的实验器材及药品 | 洗洁精家用饮水玻璃杯筷子 |
| 实验步骤 | 1、用玻璃杯取小半杯家用饮水; 2、挤倒5-6滴洗洁精,用筷子搅拌; |
| 实验现象 | 1、若产生大量泡沫,且无垢状物; 2、若几乎没有泡沫,且产生许多垢状物; |
| 实验结论 | 1、家用饮水是软水; 2、家用饮水是硬水。 |
| 注意事项 | 洗洁精也可用肥皂水代替。 |
| 序号 | 10 |
| 实验名称 | 瓶“吐”鸡蛋 |
| 家庭用到的实验器材及药品 | 吸滤瓶(可到化学仪器商店购买)去壳熟鸡蛋注射器胶皮管纯碱(Na2CO3)白醋 |
| 实验步骤 | 1、把去壳熟鸡蛋放入口径比鸡蛋略小的吸滤瓶中,让鸡蛋堵住瓶口,保持瓶口向下;2、用注射器从导管注入饱和Na2CO3溶液;3、再用注射器注入白醋; |
| 实验现象 | 1、会产生许多气泡; 2、鸡蛋被吐了出来。 |
| 实验结论 | Na2CO3溶液与醋酸反应产生二氧化碳,使瓶中的压强增大,把鸡蛋压出来。 |
| 注意事项 | Na2CO3溶液和白醋的量尽可能多一些。 |
| 序号 | 11 |
| 实验名称 | 鸡蛋“煮熟”之谜 |
| 家庭用到的实验器材及药品 | 鸡蛋玻璃杯生石灰(CaO)自来水 |
| 实验步骤 | 在玻璃杯里放入适量生石灰粉末,鸡蛋放在上面,然后倒水浸没鸡蛋。 |
| 实验现象 | 产生大量白雾;过一会儿,鸡蛋被煮熟。 |
| 实验结论 | CaO与水反应生成熟石灰Ca(OH)2,同时放出大量的热量。 |
| 注意事项 | 1Kg氧化钙和水反应,产生的热量可以烧开近两热水瓶的水。 |
| 序号 | 12 |
| 实验名称 | 自制喷泉 |
| 家庭用到的实验器材及药品 | 稀硫酸锌片红墨水广口瓶(两个)导管尖嘴玻璃管胶皮管长颈漏斗橡皮塞 |
| 实验步骤 | 取两只广口瓶,按图示装配好,右瓶的水中滴几滴红墨水,左瓶中放入锌片,从长颈漏斗中注入稀硫酸。 |
| 实验现象 | 左瓶中产生气泡;尖嘴玻璃管处像喷泉一样喷出红色的水。 |
| 实验结论 | 稀硫酸与锌反应生成氢气,氢气难溶于水,右瓶中压强增大,把水压进玻璃管中,形成喷泉。 |
| 注意事项 | 装置不能漏气;长颈漏斗下端要浸没在液体以下。 |
| 序号 | 13 |
| 实验名称 | 铁树“开花” |
| 家庭用到的实验器材及药品 | 铁丝果导片浓氨水棉球 |
| 实验步骤 | 1、把果导片捣碎,加入足量水,搅拌,静置,取上层液体得酚酞试液;2、把铁丝编成树状,把沾有酚酞的棉球挂在铁树枝上;3、把铁树放在敞口的盛有浓氨水的瓶口上方。 |
| 实验现象 | 一会儿,可看到棉球变成了红色,整个铁树就像开花了一样。 |
| 实验结论 | 浓氨水有强烈的挥发性,挥发出的氨气使无色酚酞试液变红。 |
| 注意事项 | 浓氨水挥发出的氨气有毒,尽量带上口罩。 |
| 序号 | 14 |
| 实验名称 | 变“瘪”的瓶子 |
| 家庭用到的实验器材及药品 | 雪碧饮料塑料瓶水带导管的单孔橡皮塞 |
| 实验步骤 | 1、在塑料瓶里放入约1/3的水;2、用带导管的单孔橡皮塞塞住雪碧瓶口,导管另一端放进塑料瓶里;3、一段时间后,盖紧瓶盖,用力振荡塑料瓶。 |
| 实验现象 | 塑料瓶变瘪了。 |
| 实验结论 | 雪碧饮料里产生大量气泡,那是二氧化碳,与水反应后,塑料瓶内的压强减小,外界气压把塑料瓶子压瘪了。 |
| 注意事项 | 向塑料瓶里通气体的时间要长一些,必要时可轻轻摇晃雪碧瓶。 |
| 序号 | 15 |
| 实验名称 | 巧除水垢 |
| 家庭用到的实验器材及药品 | 白醋炊壶(内有大量的“茶碱”)清水 |
| 实验步骤 | 取一内有大量“茶碱”的炊壶,向里倒入约50—100毫升白醋,左右旋转炊壶,让白醋接触“茶碱”,过一会,用较多的清水冲洗。 |
| 实验现象 | 1、“茶碱”处产生许多气泡; 2、“茶碱”逐渐脱落。 |
| 实验结论 | “茶碱”不溶于水,但能与醋酸反应,生成二氧化碳气体和能溶于水的物质,被清水冲洗掉。 |
| 注意事项 | 用白醋浸泡的时间不宜太长,防止与铝或铁反应损坏炊壶。 |
五 : 小煜同学通过学习知道,乙醇汽油是一种新型车用燃料,于是他对汽油中添加乙醇的目的进行了如下探究。【猜想
| 小煜同学通过学习知道,乙醇汽油是一种新型车用燃料,于是他对汽油中添加乙醇的目的进行了如下探究。 【猜想】猜想l:可以减少汽车尾气的污染; 猜想2:可以产生更多的热量,增强汽车的动力。 【诒计与实验】
【分析与讨论】 (1)实验I是一个对比实验,实验过程中不一定要控制的条件是(填序号); A.水的初始温度必须相同B.加热开始计时点必须相同 C.燃具产生火焰的大小必须相同 D.蒸发皿的大小必须相同 (2)汽车的发动机、排气管等部件易出现积炭,使用乙醇汽油后,这些部件产生的积炭量将; (3)目前乙醇汽油中乙醇的添加量约为10%.可一定程度节省石油资源。结合实验I的结论分析,如果乙醇的添加量过大,会使汽车动力(填“增强"、“减弱"或“不变")。 |
【设计与实验】
【分析与讨论】 (1)B (2分) (2)减少 (1分) (3)减弱 (2分) |
| 根据实验现象分析,相同条件下,分别用汽油和用乙醇加热相同质量的水,乙醇所用时间长,说明乙醇燃烧产生的热量比汽油少,即猜想2不成立;蒸发皿背面炭黑多少说明燃料充分燃烧还是不充分燃烧,用汽油加热的蒸发皿背面有大量炭黑,说明汽油比乙醇更易发生不完全燃烧,易产生一氧化碳等大气污染物,所以从环保角度分析,汽油比乙醇对环境的影响更大,也说明了用乙醇汽油代替汽油更环保;实验中用测量加热等质量的水所所需的时间判断汽油和乙醇燃烧产生热量的多少,为此需要控制相关的变量,变量一是水的超始温度,变量二是加热仪器产生火焰的大小,变量三是蒸发皿的大小(涉及蒸发皿与火焰的接触面积),由于测定的时间是从开始加热到沸腾所需的时间,所以开始计时的时间无关;由于乙醇汽油较汽油更容易充分燃烧,所以用乙醇汽油的汽车更不易发生积炭现象;但由于乙醇的热值较汽油低,添加乙酬后,汽车的动力将会减弱。 |
考点:
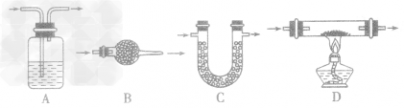
考点名称:实验室制取和收集气体的思路实验室制取气体的思路: ”的反应,简称“固体加热型”,装置如图A所示,如用KMnO4或KClO3和MnO2制O2。
”的反应,简称“固体加热型”,装置如图A所示,如用KMnO4或KClO3和MnO2制O2。  ”的反应,简称“固液常温型”,装置如图B、C、D、E。如用H2O2和MnO2制O2、用锌粒与稀H2SO4制H2或用CaCO3与稀盐酸制CO2。同B装置相比,D装置具有便于添加液体药品,制取的气体量较多的优点;C装置不仅添加液体药品方便,而且可通过导管上的开关控制反应的发生和停止;E装置可通过分液漏斗的活塞控制加入药品的量和速度。
”的反应,简称“固液常温型”,装置如图B、C、D、E。如用H2O2和MnO2制O2、用锌粒与稀H2SO4制H2或用CaCO3与稀盐酸制CO2。同B装置相比,D装置具有便于添加液体药品,制取的气体量较多的优点;C装置不仅添加液体药品方便,而且可通过导管上的开关控制反应的发生和停止;E装置可通过分液漏斗的活塞控制加入药品的量和速度。 
 ”的反应的发生装置的其他改进:
”的反应的发生装置的其他改进: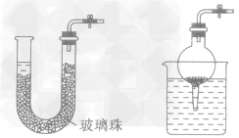
| 收集装置 |  |  |  |
| 选择条件 | 难溶或微溶于水,与水不发生化学反应的气体。如:H2、 O2、CH4等 | 不与空气发生反应,密度比空气密度大的气体。如:O2、 CO2等 | 不与空气发生反应,密度比空气密度小的气体。如:H2、CH4等 |
| 说明 | ①使用排水法收集的气体较纯净,但缺点是会使收集的气体中禽有水蒸气。当导管口有连续均匀的气泡冒出时才开始收集,当有大量气泡从集气瓶口冒出时,表明气体已收集满。 ②用向上排空气法收集气体,应注意将导管伸到接近集气瓶瓶底,同时应在瓶口盖上玻璃片,以便尽可能地排尽空气,提高所收集气体的纯度。使用排空气法收集的气体比较十燥,但纯度较低,需要验满(可燃性气体则要注意安全,点燃之前一定要验纯,否则有爆炸危险) | ||

| 吸收剂 | 吸收的气体杂质 | 吸收剂 | 吸收的气体杂质 |
| 水 | 可溶性的气体:HCl,NH3 | NaOH | CO2,HCl,H2O |
| 无水CuSO4 | H2O | 碱石灰 | CO2,HCl ,H2O |
| 灼热的铜网 | O2 | NaOH | CO2,HCl |
| 灼热的CuO | H2,CO | 浓硫酸 | H2O |
 Cu+CO2
Cu+CO2| 干燥剂 | 可干燥的气体 | 不可干燥的气体 | ||
| 名称或化学式 | 酸碱性 | 状态 | ||
| 浓H2SO4 | 酸性 | 液体 | H2、N2、O2、CO2、HCl、CH4、CO | NH3 |
| 固体NaOH、生石灰,碱石灰(氢氧化钠和生石灰的混合物) | 碱性 | 固态 | H2、O2、N2、CH4、CO、NH3等 | CO2、SO2、HCl |
| 无水CaCl2 | 中性 | 固态 | 除NH3外的所有气体 | NH3 |
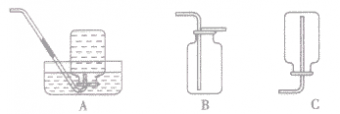
 考点名称:二氧化碳的性质实验探究二氧化碳的三个性质实验:
考点名称:二氧化碳的性质实验探究二氧化碳的三个性质实验:
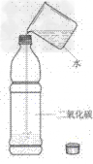
| 序号 | 1 |
| 实验名称 | 点不着的“纸” |
| 家庭用到的实验器材及药品 | 铜棒两张相同的长条白纸火柴 |
| 实验步骤 | 1、用火柴直接点其中的一张纸条; 2、将另一张纸条先以螺旋形紧紧地缠绕在铜棒上,再去点燃; |
| 实验现象 | 1、纸条迅速燃烧 2、纸条没有燃烧 |
| 实验结论 | 因为铜具有良好的导热性,将加热处的热量迅速传导散失,使其温度达不到纸条的着火点而点不着。 |
| 注意事项 | 铜棒是金属,有良好的导热性,注意勿烫手。 |
| 序号 | 2 |
| 实验名称 | “神奇”的手帕 |
| 家庭用到的实验器材及药品 | 酒精的水溶液(1:1)棉手帕钳子(两只)火柴 |
| 实验步骤 | 把棉手帕放入用酒精与水以1:1配成的溶液里浸透,然后轻挤,用两只钳子分别夹住手帕两角,放到火上点燃,等火焰减小时迅速摇动手帕,使火焰熄灭。 |
| 实验现象 | 手帕依旧完好如初。 |
| 实验结论 | 燃烧时,酒精的火焰在水层外,吸附在纤维空隙里的水分吸收燃烧放出的热量而蒸发,手帕上的温度达不到纤维的着火点,因而手帕烧不坏。 |
| 注意事项 | 由于火焰温度较高,注意别烧伤手及对着其他人,且远离其它可燃物。 |
| 序号 | 3 |
| 实验名称 | 金属性质“谁更强” |
| 家庭用到的实验器材及药品 | 白醋、铝片、铁片、铜片、剪刀、砂纸、玻璃杯 |
| 实验步骤 | 1、用三个小玻璃杯各取适量白醋,用砂纸把三种金属打磨光亮,再用剪刀剪三种金属少量分别加入白醋中; 2、用剪过剩下的铝片放入放铁的杯子中,充分振荡; |
| 实验现象 | 1、放铝和铁的杯子中产生气泡,放铜的杯子中没有,且放铁的杯子中溶液颜色变为浅绿色; 2、铝片表面出现灰黑色固体,且溶液颜色由浅绿色变为无色; |
| 实验结论 | 1、铝和铁的活动性都比铜强; 2、铝的活动性大于铁;所以:铝>铁>铜 |
| 注意事项 | 观察颜色的变化要仔细呦! |
| 序号 | 4 |
| 实验名称 | 自制碳酸饮料 |
| 家庭用到的实验器材及药品 | 凉开水250克、柠檬汁1.5克、白糖8克、小苏打(NaHCO3)1.5克、500ml饮料瓶、适量果汁 |
| 实验步骤 | 1、在约500mL的饮料瓶中加入约8克白糖和适量果汁;2、加入约1.5g小苏打;3、注入凉开水;4、再加入约1.5g柠檬汁;5、立即旋紧瓶盖,摇匀,放入冰箱。半小时后,你就可以喝到清凉甘甜的汽水了。 |
| 实验现象 | 1、产生气泡; 2、气泡消失。 |
| 实验结论 | 1、碳酸氢钠与柠檬酸反应,生成二氧化碳; 2、二氧化碳与水反应生成碳酸,即碳酸饮料。 |
| 注意事项 | 原料的量,根据口味不同,适当可以调整呦! |
| 序号 | 5 |
| 实验名称 | “切断”的烛焰 |
| 家庭用到的实验器材及药品 | 粗铜丝(多股)蜡烛火柴 |
| 实验步骤 | 1、用粗铜丝绕成一个内径比蜡烛直径稍小点的线圈,圈与圈之间需有一定的空隙;2、点燃蜡烛,把铜丝制成的线圈放在火焰的中间。 |
| 实验现象 | 铜圈上方的火焰被“切断”,下方的火焰正常燃烧。 |
| 实验结论 | 铜具有良好的导热能力。当铜丝罩在蜡烛火焰的中间时,上方火焰的热量被铜丝带走,使蜡烛火焰上方的温度低于其着火点,上方火焰就熄灭了。 |
| 注意事项 | 小心烫手呦! |
| 序号 | 6 |
| 实验名称 | 瓶“吃”鸡蛋 |
| 家庭用到的实验器材及药品 | 熟鸡蛋白醋广口瓶蘸有酒精的棉球火柴镊子 |
| 实验步骤 | 1、将熟鸡蛋浸在白醋中,待鸡蛋壳变软后,将蛋取出;2、找一个瓶口略比鸡蛋小的广口瓶,往广口瓶中投入一燃着的酒精棉球,迅速将鸡蛋的小头对准瓶口。 |
| 实验现象 | 1、鸡蛋壳表面产生许多气泡; 2、鸡蛋很快被吸入瓶中。 |
| 实验结论 | 酒精燃烧消耗瓶中氧气,瓶中压强低于外界大气压,外界气压把鸡蛋压入瓶中。 |
| 注意事项 | 注意鸡蛋放入瓶口的时机;瓶中的鸡蛋可能会变硬。 |
| 序号 | 7 |
| 实验名称 | 水变“汽水” |
| 家庭用到的实验器材及药品 | 白醋(CH3COOH)碱面(Na2CO3)自来水玻璃棒细玻璃杯 |
| 实验步骤 | 1、取适量碱面溶于水,用玻璃棒搅拌,形成澄清液体;2、倒入白醋。 |
| 实验现象 | 可看到有大量气泡从液体中涌出,犹如“汽水”一般。 |
| 实验结论 | 碳酸钠与醋酸反应生成二氧化碳气体。 |
| 注意事项 | 白醋与碱面的量,可以自己控制呦! |
| 序号 | 8 |
| 实验名称 | 水变“牛奶” |
| 家庭用到的实验器材及药品 | 碱面生石灰自来水玻璃棒细玻璃杯 |
| 实验步骤 | 1、取适量碱面和生石灰,分别溶于水,用玻璃棒搅拌,取上层清液于两细玻璃杯中;2、把一细玻璃杯中的液体倒入另一细玻璃杯中。 |
| 实验现象 | 产生像“牛奶”一样的白色浑浊。 |
| 实验结论 | 1、生石灰与水反应生成氢氧化钙; 2、碳酸钠与氢氧化钙反应生成碳酸钙,碳酸钙难溶于水。 |
| 注意事项 | 因为石灰有腐蚀性,在配制石灰水时,注意安全,防止溅到皮肤、衣服,特别是眼睛。 |
| 序号 | 9 |
| 实验名称 | 硬、软水检验 |
| 家庭用到的实验器材及药品 | 洗洁精家用饮水玻璃杯筷子 |
| 实验步骤 | 1、用玻璃杯取小半杯家用饮水; 2、挤倒5-6滴洗洁精,用筷子搅拌; |
| 实验现象 | 1、若产生大量泡沫,且无垢状物; 2、若几乎没有泡沫,且产生许多垢状物; |
| 实验结论 | 1、家用饮水是软水; 2、家用饮水是硬水。 |
| 注意事项 | 洗洁精也可用肥皂水代替。 |
| 序号 | 10 |
| 实验名称 | 瓶“吐”鸡蛋 |
| 家庭用到的实验器材及药品 | 吸滤瓶(可到化学仪器商店购买)去壳熟鸡蛋注射器胶皮管纯碱(Na2CO3)白醋 |
| 实验步骤 | 1、把去壳熟鸡蛋放入口径比鸡蛋略小的吸滤瓶中,让鸡蛋堵住瓶口,保持瓶口向下;2、用注射器从导管注入饱和Na2CO3溶液;3、再用注射器注入白醋; |
| 实验现象 | 1、会产生许多气泡; 2、鸡蛋被吐了出来。 |
| 实验结论 | Na2CO3溶液与醋酸反应产生二氧化碳,使瓶中的压强增大,把鸡蛋压出来。 |
| 注意事项 | Na2CO3溶液和白醋的量尽可能多一些。 |
| 序号 | 11 |
| 实验名称 | 鸡蛋“煮熟”之谜 |
| 家庭用到的实验器材及药品 | 鸡蛋玻璃杯生石灰(CaO)自来水 |
| 实验步骤 | 在玻璃杯里放入适量生石灰粉末,鸡蛋放在上面,然后倒水浸没鸡蛋。 |
| 实验现象 | 产生大量白雾;过一会儿,鸡蛋被煮熟。 |
| 实验结论 | CaO与水反应生成熟石灰Ca(OH)2,同时放出大量的热量。 |
| 注意事项 | 1Kg氧化钙和水反应,产生的热量可以烧开近两热水瓶的水。 |
| 序号 | 12 |
| 实验名称 | 自制喷泉 |
| 家庭用到的实验器材及药品 | 稀硫酸锌片红墨水广口瓶(两个)导管尖嘴玻璃管胶皮管长颈漏斗橡皮塞 |
| 实验步骤 | 取两只广口瓶,按图示装配好,右瓶的水中滴几滴红墨水,左瓶中放入锌片,从长颈漏斗中注入稀硫酸。 |
| 实验现象 | 左瓶中产生气泡;尖嘴玻璃管处像喷泉一样喷出红色的水。 |
| 实验结论 | 稀硫酸与锌反应生成氢气,氢气难溶于水,右瓶中压强增大,把水压进玻璃管中,形成喷泉。 |
| 注意事项 | 装置不能漏气;长颈漏斗下端要浸没在液体以下。 |
| 序号 | 13 |
| 实验名称 | 铁树“开花” |
| 家庭用到的实验器材及药品 | 铁丝果导片浓氨水棉球 |
| 实验步骤 | 1、把果导片捣碎,加入足量水,搅拌,静置,取上层液体得酚酞试液;2、把铁丝编成树状,把沾有酚酞的棉球挂在铁树枝上;3、把铁树放在敞口的盛有浓氨水的瓶口上方。 |
| 实验现象 | 一会儿,可看到棉球变成了红色,整个铁树就像开花了一样。 |
| 实验结论 | 浓氨水有强烈的挥发性,挥发出的氨气使无色酚酞试液变红。 |
| 注意事项 | 浓氨水挥发出的氨气有毒,尽量带上口罩。 |
| 序号 | 14 |
| 实验名称 | 变“瘪”的瓶子 |
| 家庭用到的实验器材及药品 | 雪碧饮料塑料瓶水带导管的单孔橡皮塞 |
| 实验步骤 | 1、在塑料瓶里放入约1/3的水;2、用带导管的单孔橡皮塞塞住雪碧瓶口,导管另一端放进塑料瓶里;3、一段时间后,盖紧瓶盖,用力振荡塑料瓶。 |
| 实验现象 | 塑料瓶变瘪了。 |
| 实验结论 | 雪碧饮料里产生大量气泡,那是二氧化碳,与水反应后,塑料瓶内的压强减小,外界气压把塑料瓶子压瘪了。 |
| 注意事项 | 向塑料瓶里通气体的时间要长一些,必要时可轻轻摇晃雪碧瓶。 |
| 序号 | 15 |
| 实验名称 | 巧除水垢 |
| 家庭用到的实验器材及药品 | 白醋炊壶(内有大量的“茶碱”)清水 |
| 实验步骤 | 取一内有大量“茶碱”的炊壶,向里倒入约50—100毫升白醋,左右旋转炊壶,让白醋接触“茶碱”,过一会,用较多的清水冲洗。 |
| 实验现象 | 1、“茶碱”处产生许多气泡; 2、“茶碱”逐渐脱落。 |
| 实验结论 | “茶碱”不溶于水,但能与醋酸反应,生成二氧化碳气体和能溶于水的物质,被清水冲洗掉。 |
| 注意事项 | 用白醋浸泡的时间不宜太长,防止与铝或铁反应损坏炊壶。 |
61阅读| 精彩专题| 最新文章| 热门文章| 苏ICP备13036349号-1